BINDEVEVSSYKDOMMER (REV 021-033)
61 Systemisk Lupus Erytematosus (SLE) (REV 021)
Systemisk lupus erythematosus
Jan Tore Gran and Øyvind Palm
Kjennetegn på systemisk lupus (SLE)
Unge kvinner angripes hyppigst.
Artritt i fingre, eksem, særlig med “sommerfugl”-utbredelse i ansiktet og slitenhet er vanlig.
Sykdommen varier mellom mildt sykdomsforløp uten skader på inder organer hos noen, mens andre preges av skade på ledd, hud, blodceller, nervesystem, hjerte, lunger og nyrer.
Antinukleære antistoff (ANA) påvises alltid ved aktiv sykdom. Spesifikke undergrupper omfatter anti-DNA, anti-Sm, anti-c1q, SSA og SSB.
Urinprøve er obligatorisk for å vurdere tegn til nyre-manifestasjon.
Immunkomplekser i biopsi (hud, nyre) styrker diagnosen.
Diagnosekoder ICD-10:M32.8; M32.1 SLE med organ-affeksjon (N08.5* nyre; I32.8* perikarditt, J99.1* lunge)
Prosedyrekoder: 6-minutter gangtest: FYFX05. Intravenøs infusjon: WBGM00. Behandling med belimumab: L04AA26. Intravenøs infusjon med cytostatika: WBOC05. Behandling med cyklofosfamid: L01AA01. EKG: FPFE15
ATC koder (for legemiddelstatistikk): L04A A Immunsuppressive legemidler
Definisjon
Systemisk lupus erythematosus (SLE) er en klassisk autoimmun bindevevssykdom der eget immunsystem blir for aktivt og ved en feil kan angripe nesten ethvert av kroppens egne organer. Sykdommen rammer oftest unge voksne kvinner og barn (juvenil lupus).
Symptomer på SLE kan være: eksem, feber og artritt . Blodprøver viser betydelige immunologiske forstyrrelser, og produksjonen av auto-antistoffer er særlig uttalt. Sykdomsforløpet varierer fra person til person og over tid. SLE er en potensielt alvorlig sykdom med statistisk økt dødelighet, men prognosen har blitt mye bedre de siste årene.(Fava A, 2019).
SLE rammer ofte fertile kvinner. Optimal oppfølging før og under svangerskap er derfor spesielt viktig. Aktiv sykdom og/eller sekundært antifosfolipid syndrom firedobler risikoen for spontanabort eller dødfødsel, men optimal håndtering har vist seg å redusere risikoen (Skorpen AC, 2021).
Historie
Begrepet lupus (ulv) føres tilbake til det 12. århundre og den italienske legen Rogerius Frugard som beskrev ulcererende sår på pasientenes ben (Thomas, Jr., Donald E. 2014 The Lupus Encyclopedia). Lupus-relasjon ved SLE har flere alternative forklaringer. En forbindelse til “lupus vulgaris” er mulig, der en tuberkuløs hudsykdom i ansiktet kan ligne sår etter ulvebitt. Forbindelse til SLE ble først beskrevet som hudsykdom av Pierre Louis Alphée Cazenave i 1851. Definert som systemsykdom i 1872 av Moritz Kaposisom også beskrev sommerfugl-eksantemet (Smith CD, 1988). Kaposi beskrev også Kaposis sarkom som ikke er relatert til lupus.
Epidemiologi
SLE rammer kvinner omtrent ti ganger oftere enn menn. Sorte amerikanere er dobbelt så hyppig rammet sammenlignet med kaukasiere, og asiater har en ca. 30% økt risiko (Somers EC, 2014). De utsatte etniske gruppene har ofte tidligere sykdomsdebut og et mer alvorlig forløp (Lim SS, Arthritis Rheum 2009).
Kvinner i fertil alder, mellom 25 og 34 år, er mest utsatt. Hos 20-30% av pasientene oppstår SLE før voksen alder, oftest i tenårene. Sjeldne genetiske varianter kan føre til enda tidligere debut. SLE debuterer sjelden etter 50 års alder.
En norsk befolkningsstudie fra Oslo fant en årlig insidens på 3,0 per 100 000 og en prevalens på 51,8 per 100 000 (Lerang K, 2012). En senere dansk befolkningsstudie fant sammenlignbare data med insidens på 2,35 per 100.000 og prevalens 45,2 per 100.000 (Hermansen M, 2016).
Patogenese
Sykdomsårsaken til SLE er kompleks og involverer et samspill mellom genetiske, epigenetiske, hormonelle og immunopatologiske faktorer. Miljøfaktorer, som for eksempel infeksjoner, antas også å spille en rolle.
Dysregulering av Immunsystemet: Både det innate og det adaptive immunsystemet er involvert i SLE. Type-I interferon (IFN) spiller en viktig rolle i patogenesen ved å hyperaktivere gener som koder for pro-inflammatoriske molekyler (Barrat FJ, 2019). Det foreligger et tap av immunologisk toleranse for eget vev. Stimulert immunsystem produserer antistoffer rettet mot ulike nukleære proteiner/antigener.
Immunkomplekser og organskade: Antistoffene kan indusere dannelsen av immunkomplekser og disse bidrar til organskade via komplementsystemet. Ved aktiv SLE har pasienter ofte lavere verdier av komplement-faktorene C3 og C4.
Apoptose og autoantigener: Økt celle-død (apoptose) kan skje spontant eller utløst av miljøfaktorer. For eksempel UV-B stråler gi apoptose av keratinocytter som ved tilstedeværelse av anti-SSA (anti-Ro) antistoff føre til fotosensitivt utslett. Apoptose frigjør intracellulære autoantigener til ekstracellulært miljø. På denne måten kan autoimmunitet induseres.
Redusert evne til å fjerne apoptotisk cellemateriale fører til gjenkjennelse av autoantigener av autoreaktive celler (Gatto M, 2013). Mot slike antigener er det ikke utviklet immunologisk toleranse, noe som medfører produksjon av uhensiktsmessig store mengder pro-inflammatoriske cytokiner som kan indusere autoimmunitet. Auto-antistoffer ved SLE er rettet mot proteiner som eksponeres under apoptose. Sammenfattende, kan dysregulering av T-celler og hyperaktive B-celler ved SLE medføre produksjon av antistoffer (aDNA og andre) som er rettet mot kroppens egne strukturer. Behandlingsmessig er samspillet mellom T- og B-celler av stor interesse fordi hemming av ulike strukturer har vist seg effektivt (Accapezzato O, 2023).
Genetikk
Genetisk disposisjon er medvirkende årsaksforhold til SLE. Dette støttes av følgende observasjoner:
Økt konkordanse hos monozygote tvillinger: Monozygote tvillinger deler 100% av sitt DNA, og studier har vist en konkordanse på 20-40% for SLE hos disse tvillingene. Dette betyr at hvis en monozygot tvilling har SLE, er det 20-40% sannsynlighet for at den andre tvillingen også vil utvikle sykdommen.
Opphopning av SLE og auto-antistoffer hos førstegradsslektninger: Familiemedlemmer til personer med SLE har en 2-5% økt risiko for å utvikle sykdommen sammenlignet med normalbefolkningen. De har også en økt risiko for å ha auto-antistoffer, selv om de ikke har fullstendig SLE.
Forekomst av HLA-klasse II varianter: Personer med SLE har en høyere forekomst av genene som koder for HLA-klasse II variantene DR3 og DR15 sammenlignet med normalbefolkningen. HLA-molekyler spiller en viktig rolle i immunsystemets presentasjon av antigener til T-celler.
Medfødte komplement-mangler: Insidensen av SLE er økt hos personer med medfødte mangler i komplementsystemet, spesielt i den klassiske aktiveringsveien. Komplementsystemet er viktig for å fjerne apoptotisk materiale (døde celler). Mangler i dette systemet kan føre til en opphopning av apoptotisk materiale, som kan trigge en autoimmun respons.
Andre gendefekter: Genetisk interferonopati, mangel på prolidase og PKCδ er gendefekter som også kan forårsake SLE. Mutasjon i DNASE1L3 kan føre til ugunstig opphopning av DNA, noe som kan forårsake en tidlig og alvorlig form for SLE.
Disse observasjonene tyder på at genetiske faktorer spiller en viktig rolle i utviklingen av SLE. Forskjellige gendefekter kan føre til forskjellige sykdomsforløp, noe som indikerer at SLE ikke er en ensartet sykdom (Rivas-Larrauri F, 2016).
Symptomer
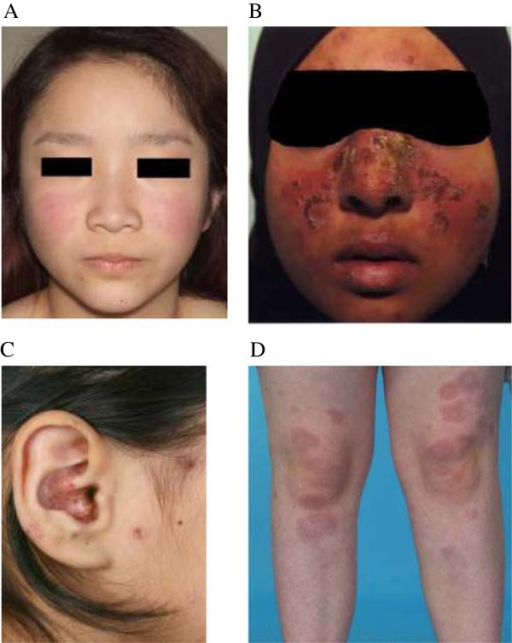
SLE kjennetegnes av individuelle, varierende sykdomsforløp. Autoimmun skade på hud, slimhinner, ledd, indre organer, blod– og nervesystem skjer i ulik grad,. Denne skaden akkumuleres over tid og kan føre til organsvikt (Dörner T, 2019). Vanlige symptomer ved SLE er fatigue, smerte, eksem, håravfall og muskel-skjelett symptomer som de vanligste plagene ved SLE.
Tidlige symptomer:
Påvirket allmenntilstand: (utmattelse/fatigue, redusert appetitt, vekttap og influensa-lignende slapphet). Samtidig kan mer typiske sykdomstrekk ses (Mok CC. 2014):
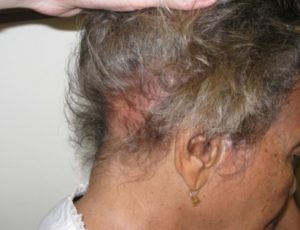
- Alopeci (oftest flekkvis håravfall)
- Artralgi (ny-oppstått, ofte fingerledd).
- Artritt (ofte symmetrisk i små-ledd/fingre, som ved tidlig revmatoid artritt (RA)).
- Eksem i ansikt (sommerfugl-utbredelse).
- Fotosensitivitet (markert utslett av lys og sol-eksponering).
- Munnsår.
- Pleuritt / pleurasmerter (smerter i thoraks ved dyp inspirasjon).
- Raynauds fenomen
Senere symptomer:
- Avaskulære skjelettnekroser
- Cytopenier (hemolytisk anemi, leukopeni eller trombocytopeni).
- Lungeblødning (diffus alveolær).
- Perikarditt og perikardvæske, ev med perikard-tamponade.
- Nevropsykiatriske symptomer (psykose, epileptiske kramper)
- Pleuravæske.
Utredning
Anamnesen bør være omfattende for å dekke alle aktuelle symptomer (se ovenfor). Tidlige symptomer (se ovenfor) kombinert med karakteristiske antistoff i serum (se nedenfor) er høyst suspekte på sykdommen, selv om klassifikasjonene for diagnosen ikke er oppfylt. Erfaring og studer viser at sykdommen utvikler seg gradvis. I noen tilfeller kan antistoff ha blitt påvist flere år før klinisk utbrudd. Sentralt i anamnesen står likevel klassifikasjonskriteriene (se nedenfor) som kan være et godt utgangspunkt. En kan kartlegge utmattelse, alopesi, orale ulcera, sommerfugl-eksantem, generalisert utslett, subakutt kutant lupus-eksem, serositt (pleura, perikard), artritt, nefritt (biopsi: nefritt klasse), feber, CNS-manifestasjoner, fotosensitivitet, Raynauds fenomen, antistoff-profil: ANA, DNA, Sm, SSA, andre og kombinasjoner, antifosfolipid antistoff (lupus antikoagulant, kardiolipin- og beta2-glykoprotein) og tromboembolier, spontanaborter og dødfødsler.
Klinisk gjøres en generell undersøkelse som omfatter hjerte, lunger, blodtrykk, hår, hud, ledd og nevrologisk vurdering ved aktuelle symptomer.
Laboratorieprøver. Rutineprøve kan omfatte CRP, SR, Hb, leukocytter med differensialtellinger, trombocytter, elektrolytter, IgG, glukose, lever-, nyre- og thyreoidea-funksjonsprøver, CK, albumin, samt antistoff (se mer nedenfor) ANA, anti-DNA, komplement C3, C4 og urin stiks.
-Anemier vanlig og oftest multifaktoriell. Kan forårsakes av jernmangel, inflammasjon, hemolyse og erythropoietin-mangel (nyreaffeksjon). Følgende tyder på hemolyse: økt bilirubin, retikulocytter og LD, samt nedsatt haptoglobin. Direkte Coombs påviser antistoffer p5 celleoverflaten.
-Leukopeni kan opptre som isolert lymfocytopeni og/eller granulocytopeni (aktivitetstegn).
-Trombocytopeni (< 100.000 x 109/L): Cellene produseres av mega-karyocytter, og produksjonen påvirkes av thrombopoietin. Levetiden er omkring 10 dager, og destruksjonen skjer hovedsakelig i milt og lever. Trombocytopeni ved SLE er vanlig, opp til 40%, men blødning er en sjeldenhet. Der er to typer trombocytopeni; En som følger sykdomsaktiviteten og ofte vil kreve avansert behandling. Den andre typen er moderat, og det er ofte ikke behov for behandling. Blant personer med trombocytopeni av ukjent årsak, utvikler ca. 2% systemisk lupus (Pamuk ON, 2023). Ved SLE og trombocytopeni skal man også være oppmerksom på bakenforliggende årsaker som stuvnings-milt, disseminert intravaskulær koagulasjon (ved infeksjon), hemolytisk uremisk syndrom, megaloblast-anemi, medikamenter, trombotisk-trombocytopenisk purpura (TTP) og Evans syndrom (trombocytopeni og autoimmun hemolytisk anemi).
-Senkningsreaksjon (SR): forhøyet hos 90 % ved aktiv sykdom.
-Polyklonal hyper-gammaglobulinemi påvist ved serum elektroforese. Høyt nivå av gammaglobulinemi korrelerer med SR, men ikke med CRP.
-C-reaktivt protein (CRP): oftest normal hvis ikke infeksjon. SLE-relatert aktiv perifer artritt eller serositt (pleuritt eller perikarditt) kan likevel øke SR.
-Komplement kan være redusert (CH50, C3 og C4) med økte mengder splittprodukter (C3d og c-aktiveringsprodukt) og TCC (terminalt komplement kompleks)
-ANA er påvisbar hos over 90 % (høy sensitivitet), men sees ved en rekke andre tilstander og blant friske (lav spesifisitet).
-Anti-ds (nativt) DNA: Immun-fluorescens/Critidia lucillae test meget spesifikk for SLE, men sensitiviteten er uakseptabel. lav (20 %). ELISA påvisning mindre spesifikt. Positiv hos 45 %. Anti-ds DNA negative har sjelden nyreaffeksjon.
–Andre antistoffer ved SLE: anti-Sm (Smith) (sensitivitet 10 %, men høy spesifisitet). anti-ss (denaturert) DNA. anti-RNP (vurder også MCTD). anti-SSA/SSB (vurder subakutt kutan lupus og Sjøgrens syndrom). Revmatoide Faktorer (RF): Hvis også positiv anti-CCP vurder “rhupus” (overlapp mot RA). Anti-kromatin antistoffer er et samlenavn for anti-nukleosom, anti-ds DNA og anti-histon antistoffer
–Antifosfolipid antistoffer (30 %) (Lupus antikoagulant, Anti-kardiolipin, anti-(beta-2-glykoprotein): Vurder om antifosfolipid syndrom (APLS) foreligger (tromboembolier eller spontanaborter).
- Tommelfingerregel: “Jo flere ANA subtyper, desto mer sannsynlig foreligger SLE”.
Bildediagnostikk
-Ledd, skjelett og sener: Ultralyd, MR, røntgen eller CT
-Lunger: Røntgen eller CT
-Hjertet: Ultralyd/ekkokardiografi, MR
-Muskulatur: MR (lårmuskler)
- Vennligst les generelt om bildediagnostikk ved bindevevssykdommer i eget kapittel
Kliniske sykdomsmanifestasjoner
Alopesi med flekkvis håravfall (alopecia areata) eller diffust hårtap til sammen hos 27-64%. Alopeci inngår i klassifikasjonskriteriene (Forouzan P, 2020).
Eksantem ses initialt hos 20-25%, i løpet av sykdommen hos 70% (Sontheimer RD 1996). Akutt og sub-akutt hud-lupus, samt diskoid lupus omfattes av klassifikasjonskriteriene. Sommerfugl-eksantem «Butterfly-rash» hos 10-50%, Soleksem 40% (særlig ved SSA/SSB antistoff i høye titere), purpura 15%, diskoid lupus 10-12%, Urticaria 8%, Andre typer dermatitt (bulløse former, urtikariell vaskulitt, papulo-nodulær form, erythema annulare) (Stull C, 2023).
SLE-varianter med dominerende hudmanifestasjoner (kutan LE)
Det er uklart om de forskjellige variantene av kutan lupus representerer egne sykdommer eller subgrupper av SLE.
Sollys antas å være en viktig årsaksfaktor for de fleste variantene. Det er viktig å være klar over at sollys kan utløse lesjoner hos personer som ikke rapporterer fotosensitivitet.
Røyking er en annen viktig årsaksfaktor. Andelen røykere er høyere blant pasienter med kutan lupus enn i befolkningen generelt. Hos pasienter som røyker, vil 40 % respondere på behandling med hydroksyklorokin (Plaquenil), sammenlignet med over 90 % av ikke-røykere. En mulig forklaring er at nikotin hemmer lysosomal akkumulering av hydroksyklorokin, og dermed hindrer virkningen av legemiddelet.
Diskoid Lupus Erythematosus (DLE): Kun hudaffeksjon uten tegn til andre organmanifestasjoner.
-Chilblain LE: DLE-liknende plakk på dorsale og laterale deler av hender, føtter, ører, nese, albu eller knær. Noduli. Hypergammaglobulinemi og revmatoide faktorer kan påvises hos noen. Debuterer gjerne i kuldeperioder. Ved lokalisasjon til fotsålene er det en risiko for nekroser. Ved opptreden av Chilblain lupus som eneste manifestasjon, er risikoen for å utvikle SLE omkring 18 % (Whitman PA, 2020).
-LE profundus: Lupus pannikulitt som er en variant av Kutan LE. Noduli. Ofte DLE.
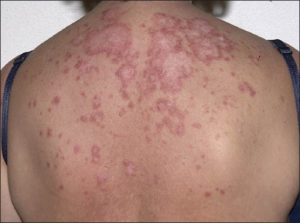
-Hypertrofisk LE: Indurerte og hyperkeratotiske plakk. Ofte samtidig DLE.
-Kronisk granulomatøs sykdom: Hereditær, residiverende infeksjoner.
-Neonatal SLE: Svært mange har dermatitt. Mor med SSA/B (Ro/La) antistoff i høye titere. (Vennligst se mer nedenfor under Svangerskap).
-SCLE (Subakutt Kutan LE)
SCLE er en autoimmun sykdom som rammer huden og kan gi symptomer som tørrhet i slimhinner (sicca-symptomer) og følsomhet for sollys (fotosensitivitet). Den rammer oftest kaukasiske kvinner i 50-årsalderen. SSA/B-antistoff som ved Sjøgrens syndrom.
Symptomer. Hudforandringer er viktigste symptom. Eksemet starter ofte med små, røde og lett skjellende makula som utvikler seg til enten psoriasis-lignende eller runde former. Utslettet forekommer vanligvis på lysutsatte områder som hals, nakke, bryst, overarmer og i mindre grad ansikt. Kantene er ofte røde og kan noen ganger ha skorper. Det kan ha sentral hypopigmentering (fargeavsvekkelse).
Undersøkelser kan vise forhøyet senkningsreaksjon (SR), leukopeni og i sjeldne tilfeller affeksjon av indre organer.
Antistoff: ANA (antinukleære antistoffer) hos 75-80% av pasientene. Anti-SSA (Ro) hos 40-100%, som også er assosiert med Sjøgrens syndrom. Anti-SSB (La) hos 12-42%. Revmatoide faktorer (RF) hos 33% (Jore S, 1997).
Histopatologiske forandringer ligner diskoid lupus, men uten hyperkeratose (fortykkelse av det ytterste hudlaget) eller follikulær plugging (tilstopping av hårsekker).
Hudbiopsi (stansebiopsi): til lmmunfluorescens undersøkelse: Hvis biopsi er tatt fra Iys-eksponert område er den positiv (nedslag av lg og komplement i den dermo-epiteliale overgangssonen) hos 90%, men mange falske positive. Tatt fra ikke-soleksponert område (Lupus band test) er testen mindre sensitiv, men mer spesifikk for diagnosen SLE. Ved Diskoid lupus (DLE) påvises ikke nedslag i uaffisert hud.
Behandling: hydroksyklorokin og solbeskyttelse (Jore S, 1997).
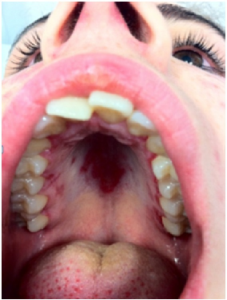
Slimhinner
Ulcera i munn (foto ovenfor) og slimhinner. Orale sår inngår i klassifikasjonskriteriene. De er ofte små, runde sår og kan være smertefulle. Tunge og svelg kan også rammes. Sekundært Sjøgrens syndrom medfører daglig tørrhet i øyne og munn, oftest etter flere års sykdomsforløp.
Bevegelsesapparatet (von Vugt RM, 1998; di Metteo A, 2018)
Artralgier oppstår hos nesten alle (95%) og ca. 50% debuterer med muskel-skjelett symptomer.
- Non-erosiv artritt og tenosynovitt hos noen. Artritt inngår i klassifikasjonskriteriene.
- Erosiv polyartritt (“Rhupus-artritt”) sjelden. Ofte anti-CCP antistoff.
- Jaccoud deformiteter i føtter/hender (likner RA) hos 10 %. Svekket sene-apparat med til dels betydelige feilstillinger i fingre, ankler og føtter, men fravær av usurerende skjelettskader ved bildediagnostikk.
- Aseptisk bennekrose (hofter, skuldre) hos 4-30%
- Kan også ses sekundært til høye doser kortikosteroider
- Tenosynovitt
- Subklinisk myositt kan ses hos 15%, myalgi hos de fleste av disse og i alt hos nær 80%. Lett forøkelse av kreatin kinase (CK) i blodet kan ses.
Pulmonale manifestasjoner
En kan dele lungemanifestasjonene ved systemisk lupus i åtte tilstander (Shin JIL, 2022).
- Pleuraaffeksjon med eller uten væske (55 %)
- Pleuravæske
- Akutt pneumonitt (ikke infeksjon)
- Kronisk diffus interstitiell lungesykdom (sjelden)
- Pulmonal hypertensjon (sjelden)
- Pulmonal hemoragi (diffus, alveolær lungeblødning)
- «Shrinking lung syndrome» (foto ovenfor: diafragmadysfunksjon med høystand av diafragma).
- Lungeemboli (ved sekundært antifosfolipid syndrom)
Kardiovaskulære sykdommer ved SLE
Kardiovaskulære komplikasjoner er mer vanlig ved SLE enn i befolkningen ellers. Fokus på disse er derfor viktig for å redusere mortaliteten ytterligere (Frostegård J, 2023).
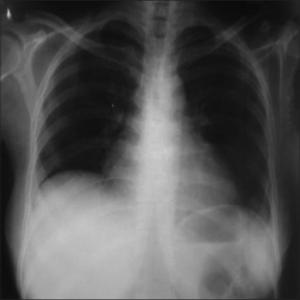
- Perikarditt (klinisk 29 %, ved EKKO 37 %, ved autopsi 66 %).
- Tachykardi uten feber (vanlig). Vanligvis ellers normale funn ved hjerteundersøkelse, men endokarditt må utelukkes. Vanligst er sinus-tachykardi (opptil 50% av pasientene), atrieflimmer og ekstraslag og at forekomsten korrelerer med sykdomsaktivitet i myokard (Teixeira, R.A. 2014). Maligne ventrikulære arytmier ses imidlertid sjeldent ved SLE.
- Kardiomyopati.
- Endokarditt (Libman-Sachs 13-65 %, bakteriell 2 %).
- Myokardinfarkt kan forekomme i tidlig sykdomsfase og påvises ved EKG, samt stigning av CK-MB og cTnl (Troponin som er spesifikt for myokardskade).
- Myokarditt (ved EKKO 2 %).
- Koronar arteritt (8 %, høy mortalitet)
- Pulmonal hypertensjon (økt trykk i høyre atrium og lungearterien): 4% ved SLE, referanse: Parabu A, 2009)
Personer med SLE har en 5 til 50 ganger høyere risiko for myokardinfarkt sammenlignet med normalbefolkningen. Mange pasienter med SLE kan ha plakkdannelse i koronarkar før de får hjerteinfarkt. Ultralyd av carotis- og femoralis-arteriene kan diagnostisere plakk og økt intima-media fortykkelse, som er risikofaktorer for ateromatose sykdom. Årsaker til økt risiko for ateromatoseer bl.a. dyslipidemi og hypertensjon og insulinresistens sekundært til nyresykdom (Njeves CEF, 2016).
Av alle SLE-pasienter har 16 % nefritt ved sykdomsdebut. Komplikasjonen utvikles oftest innen de tre første sykdomsårene. Klinisk vil 40-70 % ha nyre-affeksjon i forløpet (Mahajen A, 2020).
-Nyre-manifestasjonene er i første rekke glomerulonefritt med histologisk immunkompleksnedslag. Glomerulonefritt medfører progredierende irreversibelt nefrontap og må påvises tidligst mulig for å oppnå best best behandlingsrespons. Nyresykdom kartlegges anamnestisk, klinisk, ved prøver fra urin, blod og ved behov også fra vev (nyre-biopsi). Pasienter med Lupus-nefritt har statistisk sett mindre utslett, artritt og Raynauds-fenomener, men oftere alopesi og orale ulcera. Proteinuri (>0,5g/L ) og biopsi-funn (nefritt klasse III/IV og klasse II/V) inngår i klassifikasjonskriteriene.
-Diagnosen Lupus-nefritt baseres på proteinuri (> 0,5 g i spot urin, høy protein/kreatinin ratio eller > 3+ ved stiks), urin mikro med cellesylindre (røde blodlegemer, hyaline, kornede eller blandede) og hematuri (> 5 per synsfelt) eller dysmorfe erytrocytter (skyldes konsentrasjon i tubuli), nedsatt GFR og hypertensjon. Nesten 100 % har proteinuri, hvorav 45-65% har nefrotisk syndrom. Mikroskopisk hematuri kan påvises hos 80% (Norby GE, 2010).
-Klinisk domineres Lupus-nefritt av proteinuri og nefrotisk syndrom. Nefrotisk syndrom kan kompliseres med akselerert aterosklerose, venøs trombose og trombose av vena cava. Anti-trombin skilles ut sammen med albumin slik at proteinuri gir økt risiko for venøse tromboser. Tap av immunglobuliner ved proteinuri kan gi økt infeksjonsrisiko. Typen og graden av nyre-affeksjonen bør oftest bestemmes histologisk ved nyrebiopsi. Behandlingen er et race mot nefrontap. Hydroksyklorokin (Plaquenil) bør ikke brukes ved nefrotisk syndrom.
-Akutt nyresvikt ved SLE er ofte relatert til mikrotromber i renale kapillærer ved TTP / HUS, trombose i nyrearterier og vener ved samtidig antifosfolipid antistoff syndrom (sekundært ApLs) eller akutt interstitiell nefritt med immunkomplekser langs den tubulære basalmembranen (Joseph RE, 2001)
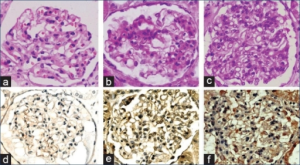
-Funn ved nyrebiopsi. Ved autopsi eller ved elektron-mikroskopi har omtrent alle forandringer i glomeruli.
Det hyppigste funnet er hyper-cellularitet (fra celler i glomeruli som endotel, epitel og mesangiale celler). Wire-loop ytrer seg som eosinofil fortykkelse av glomerulus basalmembran. Halvmånedannelse er synonymt med ekstrakapillær proliferasjon. Cellene kommer fra det parietale epitel av Bowmans kapsel. Fibrinoid er et ekstracelluIært inflammatorisk eksudat (fibrin, serumproteiner, immunaggregater og ekstra-cellulære matriksproteiner som for eksempel fibronektin). Nekrose er neutrofile infiltrater med karyorrhexis (fragmenter av cellekjerner), fibrin eksudater og diskontinuiteter i basalmembranen. Hematoksylinlegemer er dannet av degenerert materiale fra cellekjernen. Sees hos bare 25 %, men er diagnostisk for SLE. Ved nyrebiopsi bør det skilles mellom aktive lesjoner (glomerulær celleproliferasjon, leukocytt-eksudasjon, fibrinoid nekrose, hyalin avleiring, cellulære halvmåner og interstitiell inflammasjon). Kroniske forandringer (glomerulær sklerose, fibrose halvmåner, tubulær atrofi og interstitiell fibrose).
Ved nyrebiopsi bør følgende has i mente:
- Aktivitetsgrad: Viser biopsien mindre grad av aktive lesjoner, men samtidig akutt tubulo-interstitiell nefritt, må andre årsaker til nyresvikt enn SLE undersøkes.
- Prognose: Dårligst nyreprognose foreligger ved kroniske lesjoner.
- Interpretasjon av funn: Funnene må tolkes i lys av hvor mange glomeruli som er funnet. For eksempel:
- Ved 10 glomeruli er det en 35% sjanse for å ikke finne affiserte glomeruli, forutsatt at 10% av alle er angrepet.
- Ved 20 glomeruli reduseres sjansen til 12% for å miste fokale forandringer.
- Tubulus dysfunksjon: Mange nefrittpasienter har både proksimal og distal tubulus dysfunksjon.
- Segmentale vs. fokale forandringer:
- Segmentale forandringer: Bare en del av glomerulus er affisert, og ikke alle glomeruli har forandringer.
- Fokal nefritt: Mindre enn 50% av glomeruli er affisert.
- Diffus nefritt: >50% av glomeruli er angrepne.
- Hematoksylin-legemer: Dannet av degenerert materiale fra cellekjernen. Sees hos bare 25%, men er diagnostisk for SLE.
- Immunhistokjemiske undersøkelser: Nedslag av flere typer immunglobuliner, C3 og C3 er typisk for LN inntil det motsatte er bevist.
- Overvåking etter biopsi: Pasienten overvåkes i 24 timer på grunn av blødningsfare.
- Transistent hematuri: Sees hos 60-80%.
- Blødninger: Ca. 2%, hvorav mindre enn 50% trenger inngrep for å stanse blødning.
Klassifisering av nefritt (International sosciety of nefrology (2003)
| Histologisk klassifisering | Histologiske funn | Kliniske kjennetegn | |
| Klasse I | Minimal mesangial LN. Det sees normale glomeruli ved lysmikroskopi med mesangiale (mesangial-cellene er karenes støtteceller) depoter ved immunfluorescens | Minimale, ikke indikasjon for biopsi | |
| Klasse II | Mesangial proliferative LN. Mesangial hypercellularitet. | Hematuri, lavgradig proteinuri; nyresvikt, nefrotisk syndrom er uventet | |
| Klasse III | Fokal LN. Rammer <50% av glomeruli. Celleproliferasjon, lymfocyttinfiltrater, halvmåner. | Hematuri, proteinuri, nyresvikt. Nefrotisk syndrom er ikke uvanlig. | |
| Klasse IV | Diffus LN. Rammer >50% av glomeruli. | Hematuri, proteinuri, nyresvikt. Nefrotisk syndrom er ikke uvanlig. | |
| Klasse V | Membranøs LN. Gir ofte nefrotisk syndrom. Hematuri sjelden. Evt. hypertensjon. Behandles ofte med ciclosporin A. Man ser ofte kombinasjon av klasse V og III, samt klasse V og IV. | Proteinuri, ofte nefrotisk syndrom;. Hematuri forekommer. Nyresvikt er uvanlig. hematuri mulig; Vanligvis ikke nyresvikt | |
| Klasse VI | Avansert sklerotisk LN. 90% eller flere av glomeruli er skleroserte. | Nyresvikt. Proteinuri og hematuri er vanligvis tilstede. | |
Weening JJ . J Am Soc Nephrol 2004. Almaani S, Meara A, 2017 |
|||
Retikuloendoteliale manifestasjoner: Lymfadenopati (50 %). Ved påfallende ømme, vedvarende lymfeknuter på halsen bør en vurdere om Kikuchi Fujimoto sykdom (og differensialdiagnoser) foreligger samtidig med systemisk lupus. Splenomegali (15-20 %). Thymom.
Cytopeni: Cytopenier (se mer under laboratorieprøver ovenfor). Inngår i klassifikasjonskriteriene.
Vaskulært: Kutan vaskulitt på fingre (pulpa/neglesenger) og albuer. Raynauds fenomen (5-26 %, særlig ved anti-RNP positivitet). Residiverende tromboflebitt. Arterielle/venøse tromboser (antifosfolipid antistoff)
Gastrointestinale manifestasjoner: Peritonitt. Pankreatitt. Lupoid hepatitt. Vanligste årsaker til forhøyde leverenzymer ved SLE er imidlertid medikamenter som azathioprin og NSAIDs (Frittoli RB, 2021).
Øyet: Retinaforandringer vanlige (eksudater og blødninger). Akutt sentralvene / arterietrombose.
Nevrologisk: meningeal, cerebellar, spinal, perifer, cerebral, alle typer. Sekundær CNS: uremi, hypertensjon, infeksjon, koagulopati, kortikosteroider og andre medikamenter (Sarwar S, 2021).
-Perifere nervesystem: Akutt inflammatorisk demyeliniserende polyradikulitt (Guillain-Barre syndrom), autonome tilstander, mononeuropati singel-/multipleks, myastenia gravis, nevropati, pleksus sykdom, polynevropati.
-Nevropsykiatrisk lupus: Manifestasjonene er ikke spesifikke for SLE og har ofte en annen årsak. Data tyder på at bare ca. 30% skyldes lupus (Hanly JG, 2020). Nevropsykiatrisk lupus opptrer oftest tidlig i sykdomsforløpet, samtidig med andre tydelige manifestasjoner og karakteristiske antistoff i blodet. Nevropsykiatrisk (fordeling: Over 50% har hodepine 24%. Vaskulær sykdom 15%. “Mood disorders” 17%. Kognitive utfall 11% (sannsynligvis høyere). Kramper 8%, angst 4%, akutt konfusjon 4%). Psykiatrisk (alle typer). Psykoser forekommer hos 2-8% av pasientene og er da ofte debutsymptom. De fleste går i full remisjon. Hos de med psykose utvikles dette oftest (hos > 80%) i løpet av første sykdomsår. Anti-ribosom antistoff er en markør for nevropsykiatrisk SLE, men den er ikke spesifikk eller sensitiv (Deijins SJ, 2020). Patologisk foreligger som oftest mikro-tromboser (hos 37-55 %), cerebrale insulter eller vaskulitt. Blandingsformer er vanligst. ACR har definert nevropsykiatrisk lupus til å omfatte 19 ulike manifestasjoner (ACR, 1999).
-Aseptisk meningitt, cerebrovaskulær sykdom, demyeliniserende syndrom, hodepine (inkludert migrene og benign intrakranial hypertensjon), bevegelses sykdom (chorea), myelopati, krampe-tilstander, akutt forvirring, angstlidelser, kognitiv dysfunksjon, depresjonstilstander, psykose. Posterior reversible encefalopati syndrom.
-Posterior reversible encefalopati syndrom, PRES: Hodepine, synsforstyrrelser, kramper, forvirring, Høyt blodtrykk, Cerebrale MR-funn.
-Ved apopleksi er 90% iskemiske og bare 10% hemoragiske.
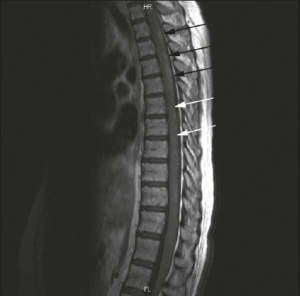
-Transvers myelitt (MR-bilde ovenfor) er en svært alvorlig komplikasjon som raskt medfører pareser og paraplegi.
-Devics syndrom består av opticus-nevritt og transvers myelitt.
-Sinusvenetrombose medfører: Hodepine, papilleødem, fokale nevrologiske symptomer, evt. epilepsi. Diagnosen stilles ved cerebral MR kombinert med venøs MR-angiografi. Man bør i slike tilfeller utelukke andre årsaker til trombose som mangel på protein C, protein S og antitrombin III, aktivert protein C resistens, antifosfolipid syndrom, bruk av orale prevensjonsmidler og hyper-homocysteinemi (Sanna. J 2008).
-Utredning av CNS manifestasjon: EEG patologisk hos nesten 80 % av pasienter med sentralnervøs SLE. Ellers utredes det med SPECT (dynamisk hjerne-scintigrafi), MR-undersøkelser, eventuelt MR-angiografi, Doppler-undersøkelse av halskar og PET/CT av hjerne og ryggmarg. Analyse av spinalvæske og nevropsykologisk testing. Utredning av differensialdiagnoser som andre former for autoimmun encefalitt og primær CNS-vaskulitt. Ved affeksjon av CNS foreligger oftest aktiv SLE sykdom. Mange pasienter har auto-antistoffer som fosfolipid antistoffer (kardiolipin, beta-2-glykoprotein og Lupus antikoagulant) og anti-ribosomalt P.
Fatigue: Et betydelig problem ved SLE er fatigue som noe forenklet kan forstås som en blanding av utmattelse og tretthet. Graden av fatigue er ikke korrelert til sykdomsaktivitet, men kan ha delvis sammenheng med smerte, depresjon og psykososiale forhold. Mellom 67 og 90% av pasientene angripes (Kawka L, 2021). Fatigue defineres ikke som CNS-manifestasjon ved SLE.
Medikament-indusert SLE
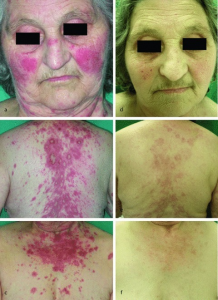
Det er rapportert mer enn 100 ulike medikamenter som kan utløse medikament-utløst lupus. Sterkes assosiasjon har prokaninamid (IC025 7,48) og hydralasin (IC0,25 6,63), men disse er sjelden i bruk. Aesculus ekstrakt (IC025 4,60) er et ekstrakt fra hestekastanje som i naturmedisin brukes mot ulike revmatiske symptomer, åreknuter og væskeoverskudd (Methlie CB, 2009). Andre utløsende medikamenter er minocyklin, ethosuximid, kinidin, infliksimab, tocainid, acebutol og cortikotropin (Arnud L, 2018).
Ofte foreligger kutane lesjoner (kutan vaskulitt 10 %), mens alvorlige organmanifestasjoner er sjelden. Polyartralgi eller artritt ses hos nesten alle, Minocyklin-indusert lupus er et eksempel som sees i forbindelse med tetrasyklinbehandling av akutt acne vulgaris. Ofte påvises forhøyde leverenzymer, ANA hos 80 %, Histon-antistoff regnes som relativt typisk, ds DNA 16 %, pANCA (ikke PR3 eller MPO-ANCA) 65 %, hyper-gammaglobulinemi 60 %. Remisjon etter seponering er hovedregelen, men kan to måneder.
Diagnose
Å stille diagnosen SLE i et tidlig stadium kan være vanskelig. Dette skyldes at symptomene varierer mye fra person til person, og at de autoimmune prosessene starter før de kliniske manifestasjonene blir synlige. Noen pasienter får først generelle symptomer, mens andre starter med symptomer fra bare ett organ, for eksempel isolert trombocytopeni. En tredje gruppe debuterer med multiorgan-sykdom..
Det finnes ingen diagnostiske kriterier for SLE (bare klassifikasjonskriterier). Diagnosen stilles på grunnlag av pasientens sykehistorie, påvisning av auto-antistoffer og eventuelle biopsier. Det er viktig å huske at klassifikasjonskriteriene for SLE først og fremst er konstruert for bruk i forskning. Ved SLE vil ofte klassifikasjonskriteriene først være oppfylt en stund etter sykdomsstart.
Det er all grunn til å mistenke SLE hvis en pasient debuterer med manifestasjoner som nefritt (nyrebetennelse) i kombinasjon med anti-dsDNA-antistoffer, eller med isolert trombocytopeni og positiv ANA (antinukleært antistoff).
Klassifikasjonskriterier
| 2019 EULAR/ACR klassifikasjons-kriterier (Aringer M, 2019) |
||
|
||
| Manifestasjoner
Nefritt (nyrebetennelse) |
Score | |
| Klasse III/IV (alvorlig nefritt) | 10 | |
| Klasse II/V | 8 | |
| Proteinuri >0,5g/d | 4 | |
| Antistoff: | ||
| Sm eller Ds-DNA | 6 | |
| Serositt | ||
| Perikarditt (Akutt) | 6 | |
| Perikardvæske / Pleuravæske økt | 5 | |
| Hud og slimhinner | ||
| Akutt kutan lupus (ACLE) | 6 | |
| Subakutt kutan eller diskoid lupus | 4 | |
| Orale sår | 2 | |
| Alopesi (uten arr) | 2 | |
| CNS (Sentralnervesystemet) | ||
| Epilepsi-lignende kramper | 5 | |
| Psykose | 3 | |
| Delir (forstyrret bevissthet) | 2 | |
| Ledd | ||
| Artritt | 6 | |
| Blodprøver | ||
| Hemolyse | 4 | |
| Trombocytopeni | 4 | |
| Leukopeni | 3 | |
| Komplement C3 og C4 lave | 4 | |
| Komplement C3 eller C4 lave | 3 | |
| Annet | ||
| Uforklart feber | 2 | |
| Antifosfolipid antistoff (lupus antikoagulant, kardiolipin eller β2-glykoprotein) | 2 | |
Mål for sykdomsaktivitet og -skade
Sykdomsaktivitet
SLEDAI 2k (SLEDAI 2000) er mest brukt, men finnes i flere versjoner. Den er praktisk og tar ca. 10 min å fullføre. Svakheter er at den ikke inkluderer forverring innen hvert organsystem eller generell bedring og forverring. Maksimal score er 105, men verdier over 20 er sjelden. (Gladmann DD, 2002)
Andre skåringssystemer for sykdomsaktivitet er SLAM, SELENA, BILAG og CLASI (Mikdashi J, 2015).
Sykdomsskade
SLICC er desidert mest brukt og ble publisert i 1996 (Gladman D, 1996). SLICC måler permanent, irreversibel skade som har vart i minst 6 måneder (med unntak av myokardinfarkt og slag som registreres uten latenstid.
Differensialdiagnoser
- Artritt: RA, psoriasis-artritt, Udifferensiert polyartritt
- Antifosfolipid syndrom
- Bennekroser: kortikosteroider
- CNS: tumor, infeksjon, iskemi/tromboemboli, posterior reversible encephalopathy syndrome (PRES). Primær CNS vaskulitt. Andre former for autoimmun encefalopati.
- Cytopeni: medikament-indusert, sykdom i benmarg (alle tre celle-rekker)
- Degos syndrom (hud-forandringer og tromboembolisk sykdom i små og mellomstore kar.
- Evans syndrom (varme-autoimmun hemolytisk anemi + trombocytopeni (Audia S, 2020)
- Fatigue: infeksjon, hypothyreose, hyperparathyreoidisme, depresjon, kronisk tretthetssyndrom (CFS, ME).
- Feber av ukjent årsak: Opportunistisk- eller tropesykdom Sweets syndrom, autoinflammatorisk sykdom, Adult Stills.
- GVHD (avstøtningsreaksjon)
- Hemolytisk anemi, autoimmun
- Hepatitt, autoimmun
- Hjertet/perikard: hjerteinfarkt, infeksiøs endokarditt / perikarditt
- Hud: roseacea, dermatomyositt, hypersensitivitets-reaksjon, Sweets syndrom
- Lunge/Pleura: lungeemboli, infeksjon, kardial svikt
- Lymfeknuter, splenomegali: Infeksjoner, lymfom, leukemi
- Makrofag aktiveringssyndrom/HLH
- Medikament-bivirkning, DRESS
- Munnsår: Behcets, metotreksat-bivirkning, mykose
- Nyrer: infeksjon, ANCA.-vaskulitt
- Tromboemboli: Primært anti-fosfolipid syndrom, Leiden-mutasjon, mangel på protein S eller protein C. Myxom, endokarditt. Idiopatisk.
- Sarkoidose
- Stills sykdom i voksen alder (adult Stills)
- Trombotisk trombocytopenisk trombose (TTP)
- Udifferensiert systemisk bindevevssykdom
Svangerskap ved SLE
Pasienter med SLE har to-tre ganger økt forekomst av komplikasjoner under svangerskap og uønskete svangerskapsutfall sammenlignet med friske kvinner (Clowse ME, 2008). Mest utsatt er pasienter som har aktiv sykdom de siste månedene før svangerskapet inntreffer eller ved sykdomsdebut under svangerskap. Utfallet av svangerskap ved SLE har blitt mye bedre de senere år. Dette skyldes i stor grad at planlegging av svangerskap, bedre behandling og tett tverrfaglig oppfølging under hele svangerskapet bidrar til redusert sykdomsaktivitet. Det er dermed sjelden man må fraråde svangerskap ved SLE.
Fertilitet. De fleste som får SLE er kvinner i fertil alder og evnen til å bli gravid er vanligvis ikke svekket. Gjennomsnittlig føder likevel kvinner med SLE færre barn enn forventet. Årsakene kan være økt forekomst av spontanaborter og dødfødsler ved aktiv SLE, sekundært antifosfolipid syndrom eller under belastingen ved å ha en kronisk sykdom velger kvinnene å få færre barn (Skorpen AC, 2021).
Planlegging. Det er viktig å planlegge et svangerskap ved SLE. Medikamenter må ikke være skadelig for fosteret, og sykdommen bør ha vært i remisjon i minst 6 måneder før konsepsjon. Etter aktiv lupusnefritt er det en fordel vente lenge, helst 2-3 år eller mer. Dette reduserer risikoen for aktiv SLE under svangerskapey, noe som øker risikoen for for tidlig fødsel og ugunstig svangerskapsutfall. Av samme grunn bør en være forsiktig med å endre velfungerende medikamenter før eller under et svangerskap, forutsatt at de ikke er skadelige. Vær oppmerksom på at hydroksyklorokin (Plaquenil) vanligvis kan brukes trygt under svangerskap og amming.
Før svangerskap bør man undersøke forekomsten av antistoffer, inkludert antifosfolipid antistoff som lupus antikoagulant, kardiolipin- og beta2-glykoprotein. Resultatet kan være avgjørende for eventuell profylakse med antikoagulantia.
Ved lupusnefritt med betydelig nedsatt nyrefunksjon (GFR <30 ml/min) vil man ofte fraråde svangerskap.
Sykdomsaktivitet under og etter svangerskap. Noen kvinner med SLE opplever høyere sykdomsaktivitet under og etter svangerskap. Data tyder på en 2-3 ganger økt risiko for sykdomsresidiv i denne perioden, særlig hos dem med noe sykdomsaktivitet kort tid før graviditeten. Ved stabil og godt kontrollert sykdom påvirkes sykdomsforløpet vanligvis lite. Det betyr at både stabile og ustabile forløp vanligvis fortsetter som før.
Uansett er den gravide i en sårbar situasjon med færre muligheter for bruk av potente medikamenter dersom sykdommen forverres.
Forekomsten av spontanabort, dødfødsler, redusert fostervekst, for tidlige fødsler og preeklampsi er økt ved SLE sammenlignet med svangerskap hos friske kvinner. Prematur fødsel er vanligst. Mest utsatt er kvinner med sykdomsaktivitet før og under graviditeten, særlig ved nyre-manifestasjon/nefritt, antifosfolipid antistoffer eller et etablert antifosfolipid syndrom (ApLs).
Teratogene medikamenter med stor risiko for fosterskader skal ikke brukes i svangerskap. Blant disse er cyklofosfamid (Sendoxan), mykofenolat (CellCept), metotreksat, leflunomid, (Arava) og angiotensinconverting enzym (ACE) hemmere / angiotensin reseptor blokkere (se mer i eget kapittel om svangerskap og revmatisk sykdom).
Kortikosteroider i høye doser kan medføre intrauterin veksthemming av fosteret og for tidlig fødsel. Prednisolon ≤ 7,5mg/dag anses som en lav dose med liten risiko for komplikasjoner i denne sammenheng. Ved alvorlig SLE må de doser kortikosteroider som er nødvendig gis for å hindre livstruende marterne komplikasjoner. I svangerskap der prednisolon-dosen var >20mg/dag er det observert prematur fødsel hos over 60% (Palmsten K, 2021).
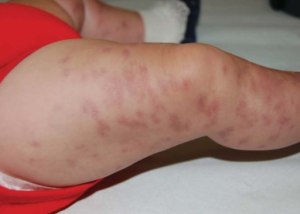
Kongenital hjerteblokk. SLE-pasienter med SSA eller SSB antistoff (vennligst se mer i kapitlet om Sjøgrens syndrom), særlig høye titere har 1-2% risiko for fostre med hjerteblokk grad III. Dette skjer mellom svangerskapsuke 16 og 26 (Andreoli L, 2017; Samaritano LR, 2020). Regelmessig registrering av fosterets hjertefrekvens anbefales derfor. Amerikanske retningslinjer anbefaler å starte kontrollene fra svangerskapsuke 16-18 og avsluttes etter uke 26, mens europeiske retningslinjer, inklusiv de norske fra Gynekologisk forening, anbefaler kontroller fra uke 16 til og med svangerskapsuke 24 (Samaritano LR, 2020; Andreoli L, 2017; Veileder Gynekologisk forening). Kontrollene kan ofte gjennomføres av fastlege eller jordmor. Ved for lav hjertefrekvens (<110/min), henvises til fostermedisinsk ekspertise. Gynekologisk forening anbefaler at alle barn av mødre med SSA/B antistoff undersøkes med EKG før de forlater barselavdelingen (Veileder i fødselshjelp pr juni 2021). Data tyder på at hydroksyklorokin (Plaquenil) reduserer risiko for kongenitalt hjerteblokk ved SSA antistoff. Tydeligst er det vist blant SSA positive gravide som tidligere hadde hatt foster med hjerteblokk. Forekomsten ble der signifikant redusert fra 18% til 7,4% (Izmirly P, 2020). Intrauterin mortalitet ved kongenital hjerteblokk grad III er beregnet til ca. 10%. I mange tilfeller med kan barnet reddes ved implantering av pacemaker umiddelbart etter fødsel. Vennligst se også informasjon fra NKSR om gravide med SSA/SSB antistoff.
Neonatal lupus omfatter også utvikling av forbigående lupus-lignende eksantem hos den nyfødte. Eksantemet ses i mer eller mindre grad hos ca. 10% av SSA-positive mødre. Symptomet kan være kombinert med anemi, cytopeni (hos ca. 20%), forhøyede leverenzymer (hos ca. 30%) og hepato-splenomegali som oppstår innen 2 måneder post partum. Når barnet i løpet av noen måneder kvitter seg med antistoffene, forsvinner utslettet og de øvrige forandringene. Barn som får lysbehandling er spesielt utsatt for eksantem.
Preeklampsi. Gravide med aktiv SLE har økt risiko for preeklampsi, vanligvis etter svangerskapsuke 20. Sykdomsaktivitet øker risikoen, men selv lavgradig sykdom tredobler risikoen for preeklampsi og for tidlig fødsel sammenlignet med inaktiv sykdom (Skorpen CG, 2018). Tidlige symptomer er hypertensjon og proteinuri. Ingen tiltak forebygger preeklampsi med 100% effektivitet og prematur fødsel som tiltak er ofte nødvendig. Utenom SLE er også andre risikofaktorer kjent: Autoimmune sykdommer, tidligere preeklampsi, matern alder >35 år, hypertensjon, kronisk nyresvikt, overvekt (BMI >30), antifosfolipid syndrom, multiple svangerskap, assistert befruktning og lavt vitamin D tidlig i svangerskapet. Det er vist at en lav dose acetylsalisylsyre (75-150mg/d) virker forebyggende (preeklampsi OR 0,71, prematur fødsel OR 0,81, veksthemming OR 0,80; Xu T, 2015). En gir derfor vanligvis forebyggende behandling med acetylsalisylsyre (ASA, Albyl-E) i lav dose (75-150mg/d) fra svangerskapsuke 12 til alle med SLE. ASA tas helst om kvelden (NICE guidelines, 2019). En ASA-dose på 75mg/dag kan kontinueres gjennom hele svangerskapet, mens ASA-doser over 100mg/d ofte avsluttes fra svangerskapsuke 36 (eller ca. 3 uker før forventet fødsel) (veileder Norsk Gynekologisk Forening, 2020; Rolnic DL, 2017).
Tromboemboli-profylakse. Dersom det foreligger (sekundært) antifosfolipid syndrom er risikoen for tromboembolier økt, særlig i svangerskap, ved fødsel og post-partum perioden. I tillegg ses placenta insuffisiens. Kvinner som er trippel positive for lupus antikoagulant, kardiolipin- og beta2glykoprotein-antistoff eller har hatt tromboembolier før har spesiell høy risiko (Tektonidou, MG, 2019). En velger ofte profylakse med lavmolekylært heparin, for eksempel Fragmin 5000 IE, daglig i kombinasjon med ASA 75mg/dag. Lavmolekylært heparin alene i slik dose kan gis i hele svangerskapet. Oppstart før konsepsjon kan være aktuelt i tilfeller med tidlige spontanaborter i anamnesen. Behandlingen kontinueres ofte inntil 6-12 uker post-partum. Ved kombinasjon med ASA avsluttes ASA ofte 3 uker før forventet fødsel (veileder Norsk Gynekologisk Forening, 2020). Dette for å redusere risiko for blødninger, særlig intrakranielt, hos den nyfødte. Blødningsrisiko vurderes opp mot tromboemboli-risiko i hvert enkelt tilfelle. Asymptomatiske bærere av antifosfolipid antistoffer (lupus antikoagulant, anti-kardiolipin, anti-beta2-glykoprotein) gis ofte ASA 75mg/dag (uten Fragmin) forebyggende gjennom graviditeten (EULAR: Tektonidou, MG, 2019).
Trombocytopeni under graviditet forekommer ved SLE. Generelt aksepteres trombocytt-verdier ned mot 50.000 x 109/L uten spesielle tiltak, utover hyppige kontroller. Ved lavere verdier med risiko for alvorlige komplikasjoner vurderes å gi Prednisolon 20-60 mg/dag inntil trombocyttene er steget til 70.000 x 109/L. Azathioprin (Imurel) 1-2 mg/kg/dag forventes også ha effekt, men det er en latenstid på noen uker før virkningen inntreffer. Alternativer er utprøvende behandling med immunglobuliner (IVIG) eller rituksimab (i 2. eller 3. trimester) på streng indikasjon. Ved stabile trombocytt-verdier og fravær av blødninger er en tilbakeholden med medikamentell behandling. Vær oppmerksom på andre årsaker til trombocytopeni i svangerskap: Preeklampsi, HELLP syndrom (hemolyse, høye leverenzymer, lave trombocytt-tall), DIC (disseminert intravaskulær koagulasjon), TTP (trombotisk trombocytopenisk purpura), HUS (hemolytisk uremisk syndrom) (Haram K, 2003).
Oppfølging. Gravide pasienter med SLE bør følges regelmessig opp i spesialisthelsetjenesten. Dette gjelder selv om sykdommen er i en rolig/inaktiv fase. Vær oppmerksom på at risiko for komplikasjoner er størst blant førstegangsfødende generelt, og at kvinner med SLE har høyere risiko også ved påfølgende svangerskap (Wallenius M, 2014). Det er en fordel med konsultasjoner hos revmatolog også før svangerskap. Deretter gjøres regelmessige kontroller under graviditeten. Intervallene er avhengig av sykdomsaktivitet, komplikasjoner eller andre individuelle forhold. Også fødepoliklinikk bør følge opp regelmessig, særlig i siste trimester. Andre spesialister konsulteres ved behov avhengig av organ-manifestasjoner (nefrolog, hematolog, kardiolog) (Skorpen AC, 2021). Disse kontrollene kommer i tillegg til rutine-oppfølging i primærhelsetjenesten. Vennligst se også avsnittet om kongenital hjerteblokk ved SSA antistoff ovenfor.
-Revmatologens oppgaver er å vurdere sykdomsaktivitet og organ-funksjon før, under og etter svangerskapet. Revmatologen gir også råd om SLE-behandlingen i svangerskapet og ved ev. amming. De kliniske undersøkelsene bør omfatte vurdering av ledd, hud, indre organer, blodtrykk, ev. ødemer og undersøkelse av blod og urin. Laboratorieprøvene bør omfatte antall blodceller, kreatinin eller eGFR og urin (proteiner, erytrocytter). Hvert trimester suppleres gjerne med komplement C3, C4 og anti-ds DNA for supplerende informasjon om sykdomsaktivitet. En revmatologisk kontroll bør også foretas 6-8 uker post partum. Generelt ses noe økt forekomst av sykdomsresidiv første året etter fødsel (Götestam Skorpen, C, 2017).
Assistert befruktning. Det er generelt økende bruk av assistert befruktning mot infertilitet. Blant kvinner med SLE kan hormonal ovulasjon-stimulering øke risikoen for høyere sykdomsaktivitet eller residiv (Orquevaux P, 2017). En fraråder likevel ikke assistert befruktning hos alle med SLE, men gjør en individuell risikovurdering. Pasienter med aktiv SLE, alvorlig nyresvikt, dårlig kontrollert hypertensjon, alvorlig kardial valvulær- eller koronar-sykdom, tidligere tromboembolier eller antifosfolipid syndrom bør avstå fra hormonbasert assistert befruktning (Andreoli L, 2017). Dersom det foreligger antifosfolipid antistoff, men ikke forekomst av tromboembolier, kan forebyggende behandling med acetylsalisylsyre (ASA) og lavmolekylært heparin (Fragmin) være aktuelt (Andreoli L, 2017).
Antikonsepsjon. Riktig valg av anti-konsepsjon ved SLE er viktig. Østrogen-holdige p-piller ble tidligere generelt frarådet. Imidlertid viste en randomisert, dobbelblindet kontrollert studie at østrogen-holdige kombinasjons-preparater ikke medførte økt SLE-aktivitet, flere residiv eller tromboembolier etter 12 måneders bruk sammenlignet med placebo blant pasienter med stabil SLE og fravær av antifosfolipid antistoff (Petri M, 2005). Det er heller ikke funnet tilsvarende forskjeller sammenlignet med progesteron-piller (minipiller) i en annen studie (Sánchez-Guerrero J, 2005). I tilfeller der det foreligger tromboemboli-risiko eller SLE-aktivitet frarådes likevel østrogen-holdige p-piller. Dersom slike p-piller ikke kan brukes, er intrauterin progesteron-holdig spiral er godt alternativ (Andreoli L, 2017).
- Medikamenter under graviditet er beskrevet i kapittelet om svangerskap ved revmatisk sykdom (REV 078).
- NKSR (Nasjonalt Kompetansesenter)
Behandling
Generelle tiltak: Sykdomsforløpet ved SLE er individuelt og behandlingen bør tilpasses den enkeltes sykdomsmanifestasjoner, sykdomsforløp, komorbiditet og toleranse. Det er likevel vanskelig å forutse hvordan den enkelte vil respondere på behandlingen. De fleste pasientene behandles gjennom flere år med basisbehandling for å redusere frekvensen av residiv og eksaserbasjoner.
Sol-eksponering og spesielt solbrenthet bør unngås fordi sykdoms-aktiviteten kan øke, et residiv kan oppstå eller medikamentene bidrar til hudskader, inklusiv økt risk for hudkreft. Sørg for vitamin- D substitusjon. Solfaktor 70 anbefales, faktor 30 er for lav.
Infeksjoner øker risikoen for sykdomsaktivitet og bør unngås så langt som mulig. Forebyggende tiltak som “døde” vaksiner (influensa, pneumokokker, papillomavirus, meningokokker, hepatitt, zoster) er viktig, men også å unngå å utsette seg for infeksjonsrisiko (backpacker i Asia, Afrika etc.). Kortikosteroider, særlig høye doser (>15mg/dag) øker infeksjons-risikoen og anvendes på strenge indikasjoner. Vurder nøye gevinsten av å behandle de mildeste sykdoms-manifestasjonene. Derom T-celler er lave med CD4 <200 μL bør en vurdere forebyggende antibiotika med cotrimazol (Bactrim) mot opportunistiske mikrober. Ved betydelig neutropeni (<0,4-0,5 / ml) kan forebyggende mykose-behandling være aktuelt. I tillegg bør alltid infeksjoner behandles raskt med antibiotikum og Immunglobulin-substitusjon kan gis hvis IgG er < 4g/L.
Aterosklerose. På lengre sikt foreligger økt risiko for aterosklerose. Presiser viktigheten av å unngå overvekt og røyking. Høyt kolesterol bør behandles. Statiner er første-valget. En bør tilstrebe å holde kolesterol i blodet godt under 5 mmol/l og/eller et LDL-nivå under 3 mmo1/L. Hydroksyklorokin kan også ha en gunstig effekt.
Treat to target. Før en begynner bør en sette mål som skal nås hvis behandlingen virker etter hensikten (“treat to target”). Realistiske behandlingsmål kan være fravær av klinisk sykdomsaktivitet (remisjon etter legens vurdering) og prednisolon ≤ 5mg/dag, Man kan ta utgangspunkt i individuelle manifestasjoner eller sykdomsaktivitet (se også avsnitt ovenfor) målt ved kompositt-score: BILAG (British Isles Lupus Assessment Group), SLEDAI (Systemic Lupus Erythematosus Disease Activity Index). Ved lupusnefritt er behandlingsmålet å oppnå komplett renal respons. Fordi nyresykdommen kan vedvare til tross for god klinisk behandlingseffekt, anbefaler noen en ny nyrebiopsi og histologisk/immunopatologisk behandlingsmål etter 1-2 års behandling (Parodis I, 2020). Selv om nyere medikamenter og kombinasjonsbehandlinger har bedret utfallet vesentlig, er vi dessverre ennå langt fra å oppnå ønsket behandlingsmål hos de fleste pasienter med lupus-nefritt (vennligst se under Prognose nedenfor). Ved å nå behandlingsmålene vil en også hindre organskade, redusere kardiovaskulær komorbiditet, bedre pasientens livskvalitet og bedre mortalitetsraten (Yang Z, 2022).
Medikamenter
Induksjonsbehandling. Behandlingsmålet bør nås i løpet av 3-12 måneders induksjonsbehandling. Solu-Medrol, prednisolon, hydroksyklorokin, mykofenolat, belimumab og cyklofosfamid er blant medikamentene som ofte benyttes.
Vedlikeholdsbehandling begynner gjerne deretter og bør opprettholdes 2-3 år eller lenger. Hydroksyklorokin (Plaquenil) er vanligvis det siste medikamentet som seponeres.
Hydroksyklorokin. Alle pasienter bør i utgangpunktet behandles med hydroksyklorokin tabletter (Plaquenil). Det er vist at hydroksyklorokin ved SLE reduserer eksem (hos ca. 50%), artritt, organskader, lipider, hyperglykemi, tromboser, aterosklerose og infeksjons-risiko. Overlevelsen øker, sannsynligvis på grunn av effekten på lipider og glukose-metabolismen (Cairoli E, 2012; Petri M. 2011). En fryktet bivirkning er retinopati. Risiko er <1% de første fem år, <10% etter 10 år, men stiger så til 20% etter 20 års hydroksyklorokin-bruk (Melles RB, 2016). Risikofaktorer utenom varigheten av behandlingen og totalt akkumulert dose er høy alder og redusert lever eller nyrefunksjon (Den amerikanske øyelegeforeningen anbefaler derfor doser under 5 mg/kg/dag og øyelege-kontroll adekvat årlig etter fem års bruk (Melles RB, 2016). Andre begrensninger er tidlige opplevde alvorlige bivirkninger (CNS-manifestasjoner, eksantem, psoriasis, nedsatt syn eller hørsel).Medikamenter som benyttes ved induksjon og/eller vedlikehold er hydroksyklorokin (Plaquenil),
Kortikosteroider oralt (prednisolon) eller intravenøst (metylprednisolon) i alvorlige tilfeller. De aller fleste trenger kortikosteroider, i alle fall det første året. Det er enighet om at en bør unngå lengere tids behandling på grunn av potensielle bivirkninger som infeksjoner, diabetes, katarakt, osteoporose, gastrointestinal blødning og aterosklerose. Praksis viser imidlertid at seponering av prednisolon 5mg/dag øker residiv-raten fire ganger. En må derfor vurdere indikasjonen for prednisolon og andre kortikosteroider nøye i hvert enkelt tilfelle (Math A, 2020). For å kunne bruke minst mulig kortikosteroider kombineres ofte med DMARDs.
csDMARDS som brukes ved SLE omfatter som hydroksyklorokin, metotreksat, azathioprin, mykofenolat, takrolimus, ciclosporin A eller cyklofosfamid (i behandlingsrefraktære, alvorlige tilfeller). Voklosporin er en nyere calcinurinhemmer som har bedre farmakokinetikk enn ciclosporin A. Monitorering av medikamentspeil i blod er til forskjell fra ciclosporin ikke nødvendig. Voklosporin er derfor et aktuelt behandlingsalternativ for lupusnefritt (Rovin BH, 2021), men høy medikamentkostnad begrenser foreløpig (2023) bruken.
Biologisk behandling (bDMARDs) hemmer samspillet mellom B-celler og T-celler via blokkering av overflatestrukturer som er viktige i patogenesen. Belimumab (Benlysta) hemmer B-celleaktivitet ved å blokkere BAF (B-celle aktiveringsfaktor) og vurderes som tilleggsmedikament (“add on”) ved utilstrekkelig effekt av annen behandling. Daratumumab hemmer også B-celler, men ved å blokkere CD-38 (anti-CD-38) og obinutuzumab blokkerer CD-20 (anti-CD-20). Anifrolumab bruker at annet prinsipp ved å hemmer T-celler via type-1 interferon reseptor og er et annet “add on” behandlingsalternativ (Murphy G, 2019; Morand EF, 2020; Marinho A, 2023). Rituksimab hemmer B-celler, slik at nivået synker betydelig i blodet. Imidlertid er vevspenetrasjonen til blant annet lymfeknuter og benmarg ikke like god, noe som kan forklare skuffende virkning ved SLE (Kamburova EG, 2013). Rituksimab vurderes likevel i enkelte, behandlingsrefraktære tilfeller ved CNS- eller hematologiske manifestasjoner (Merill JT, 2010). Valg av medikament gjøres delvis avhengig av hvilke organmanifestasjoner som foreligger og hvilke av dem som er viktigst å kontrollere (Fanpouirakis A, 2019) (Thomas Dörner, Richard Furie, 2019) (Fanouriakis A, 2020).
CAR-T cellebehandling. Et nytt behandlingsprinsipp under utprøving i revmatologi. CAR-T celleterapi benytter genteknologi å omprogrammere T-celler slik at de angriper spesifikke overflatestrukturer på B-celler. Metoden benyttes i kreftbehandling mot aggressiv B-celleleukemi og lymfom. CAR-T celle behandling rettet mot CD-19 B-celler (anti-CD-19 CAR-T) har vist svært god effekt i utprøvende behandling mot alvorlig SLE. Videre studier vil vise om den oppnådde medikamentfrie remisjonen og normalisering av antistoff holder seg over tid og at nye bivirkninger ikke observeres. Til nå er noe økt infeksjonsrisiko observert. (Jin X, 2021; Mitra A, 2023).
Behandling av organmanifestasjoner
Nefritt. Nyremanifestasjon er en vesentlig årsak til alvorlig nyresvikt og død ved SLE. Behandlingsmål omfatter å bedre overlevelse, opprettholde nyrefunksjonen over tid, unngå sykdomsresidiv og bedre livskvaliteten. Nyrebiopsi anbefales ved tegn på nyre-manifestasjon, slik som vedvarende proteinuri (≥0,5g/24 timer) og/eller et uforklarlig fall i nyrefunksjonen (Fanouriakis A, 2020). Kortikosteroider, mykofenolat og cyklofosfamid er blant medikamentene som oftest brukes.
Antikoagulasjonsbehandling: Salisylater (ASA) brukes forebyggende mot arterielle tromboser. Marevan/heparin anvendes ved venøse tromboser. Marevan behandlingen monitorers ved INR (International Normalized Rate). I INR inngår måling av protrombintid (koagulasjonstiden i sekunder etter tilsetting av vevstromboplastin) og er følsom for koagulasjonsfaktorene ll, VII og X. INR er ratioen mellom pasientens tid og normalverdien. INR stiger altså med økende antikoagulasjonseffekt. Lav intensiv behandling er INR 2,0-3,0, høy intensiv behandling tilsvarer INR 2,5-3,5. Ved INR 6-8 er blødningsrisikoen moderat, mens den er stor ved INR > 8. Direkte orale antikoagulantia, DOAC tabletter (Pradaxa, Xarelto, Eliquis), brukes generelt som forebyggende mot tromboemboli, men er ikke godkjent for bruk ved antifosfolipidsyndrom. Årsaken er at både studier og rapporter tyder på utilstrekkelig virkning ved antifosfolipidsyndrom, i det minste for “trippel positive tilfeller” (referanse: Dufrost V, 2016 og Uthman I, 2019, TRAS studien (rivaroxaban versus warfarin); Pengo V, 2018. Tilfeller med nye blodpropper under behandling med DOAC er kjent, også fra Norge (referanse: Johnsen SJA, 2018). Antikoagulasjonsbehandling i svangerskap er beskrevet ovenfor.
Aterosklerose: Det foreligger økt risiko for utvikling av aterosklerose. Utredning som bør gjøres er blodprøver med totalkolesterol, HDL-kolesterol, triglyserid tatt fastende. LDL-kolesterol. Behandlingsmålet er å redusere risikoen for hjertekarsykdom ved å senke konsentrasjonen av kolesterol og/eller triglyserid, og hvis mulig øke konsentrasjonen av HDL (lavt HDL forhindrer normal fjernelse av kolesterol fra karveggen). Kolesterol holdes under 5,0 mmo1/1 og LDL-kolesterol under 3,0 mmo1/1) eller lavest mulig. Riktig kosthold, mosjon og røykestopp.
CNS (Sentralnervesystemet): Behandlingen er ofte med puls cyclofosfamid i.v. (kortikosteroider – puls/peroralt), men avhenger helt av alvorlighetsgraden. Følgende kan brukes som rettledende (Hanly JG, 2018):
- -Hodepine, angst, mild depresjon, isolerte krampeanfall: symptomatisk behandling, evt. puls metylprednisolon.
- -Alvorlig progredierende diffus sykdom som konfusjonstilstander, psykose, koma: Metyl-prednisolon puls, immunsuppressiva og plasmaferese.
- -Fokale manifestasjoner: Bestem antifosfolipid antistoffer, vurder kortikosteroider, cyklofosfamid og antikoagulantia.
- -Kramper: Anti-epileptika, evt. immunsuppressiva. Ved svært alvorlig sykdom kan intratekal metotreksat (MTX) med deksametason og plasmaferese benyttes.
- -Hydroksyklorokin bør vurderes midlertidig seponert på grunn av nedsettelse av “krampeterskel”.
- -Ved akutt hjerneinfarkt konsulteres nevrolog straks for vurdering, eventuelt behandling med rekombinant vevsplasminogen aktivator (alteplase – Actilyse) hvis det er gått mindre enn 3 timer siden symptomdebut.
Hjertesvikt: Først kompenseres svikten, dvs. perifert ødem og lungestuvning behandles. Så lenge det ikke foreligger klaffefeil, skal alle ha betablokkere som basisbehandling. I tillegg gis ACE-hemmer hvis det ikke foreligger nyrearteriestenose eller pasienten er en eldre kvinne med dehydrering.
Hvis ACE-hemmer gir bivirkninger (særlig hoste), er Angiotensin II reseptor-hemmer (bindes selektivt til AT1 reseptorene) som Losartan (Cozaar 50 mg) alternativ. Spironolakton (Aldactone) er også et alternativt tillegg, men dosen skal vanligvis ikke overstige 25 mg per dag. Fare for hyperkalemi hos pasienter med nyresvikt, diabetes, eldre, progredierende hjertesvikt og de med risiko for dehydrering.
Hypertensjon: Behandling av hypertensjon ved SLE er viktig for å bevare nyrefunksjonen og redusere risiko for kardiovaskulære komplikasjoner. Ved hypertoni eller vedvarende proteinuri brukes ACE hemmer, for eksempel Captopril 62,5 mg/d indisert eller enalapril (Renitec) med startdose 5 mg daglig, ev. med økning til 10-20 mg x 1-2. Alternativt angiotensin II blokkere, for eksempel losartan (Cozaar). Man bør før behandlingen startes forsikre seg om at det ikke foreligger nyrearterie-stenose og at pasienten ikke er gravid. ACE-hemmere har vasodilaterende effekt på efferente arterioler og reduseres dermed det intra-glomerulære trykket og hemmer utviklingen av sklerose. Hvis det foreligger betydelig nedsatt nyrefunksjon (serum-kreatinin-nivå over 180 – 200 mikromol/L), må all behandling med ACE-hemmere kontrolleres med tanke på kreatinin-stigning. ACE-hemmere kan ved parenkymatøs nyresykdom og hypertensjon kombineres med kalsiumblokker, evt. også med diuretika. Foreligger samtidig hjertesvikt og hypertensjon bør behandling med kalsium-antagonister som amlodipin (Norvasc 5-10 mg x 1) overveies.
Leukopeni: Kortikosteroider, immunsuppressiva (azathioprin med flere), gammaglobulin.
Osteoporose: Pasientene er utsatt på grunn av kortikosteroider i behandlingen, de bør unngå mye sol-lys (D-vitamin), forebyggende fysisk aktivitet kan være forhindret. Måling av benmasse (BMD) ved dexa-scanning tidlig i sykdomsforløpet anbefales hvis prednisolon eller annet kortikosterodi bruks, slik at en har en senere sammenligningsgrunnlag. Kontroll etter 2-3 år. Profylakse med kalsium (1000mg/d og D-vitamin (800IE/d) dersom behandling md kortikosterodier anbefales. Ved osteoporose vurderes om det er behov for bisfosfonater (oralt eller iv), teriparatide, denosumab eller raloxifen (ikke for pre-menopausale kvinner). Vennligst les om osteoporose i eget kapittel.
Trombocytopeni: -Perorale kortikosteroider initialt (1 mg/kg/dag). -Rituksimab. -Azathioprin eller mykofenolat. -Cyclofosfamid, ev. rituksimab (MabThera, Rixarthon). -Gammaglobulin (Oktagam 100-400 mg per kg). -Plasmaferese. -Andre cytostatika/immunsuppressiva. -Vurdere splenektomi hvis steroidsvikt eller høy vedlikeholdsdose.
Tabell. Valg av systemisk medikasjon basert på alvorlighetsgrad. Best evidens foreligger for hydroksyklorokin, kortikosteroider og belimumab (modifisert etter Mucke J, 2020).
| Mild | Moderat | Alvorlig | |||
| 1. Valg | Refraktær | 1. valg | Refraktær | 1. Valg | Refraktær |
| Hydroksyklorokin | |||||
| Kortikosteroider p.o (i.m) | Kortikosteroider p.o./ i.v. | ||||
| Metotreksat/Azathioprin | |||||
| Belimumab | |||||
| calcineurinhemmer, Vocolosporin | |||||
| Mykofenolat (MMF) | |||||
| Cyklofosfamid | |||||
| Rituksimab | |||||
Kirurgi
Pasienter med systemisk lupus (SLE) er utsatt for osteonekrose med påfølgende behov for protesekirurgi. Imidlertid medfører bedret medikamentell behandling og oppfølgning at stadig flere med SLE utvikler artrose av aldersgrunner eller forårsaket av tidligere leddskade (Mukherjee S, 2015). Ved kirurgi, som ved innsetting av leddproteser, bør en være oppmerksom på økte komplikasjonsfarer som blødninger (trombocytopeni, anemi, behov for blodtransfusjoner) og at infeksjoner i lunger, urinveier og hud kan medføre sepsis. Sammenlignet med non-lupus pasienter er postoperativ sepsis funnet å være fire ganger økt (Gholson JJ, 2018).
Oppfølging
Når en pasient er diagnostisert, informert og behandlingen påbegynt, begynner en lang oppfølging. Det er tre overordnede aspekter:
- Utelukke tegn til livstruende manifestasjoner
- Ingen infeksjonstegn
- Fravær av sykdomsaktivitet klinisk og i blod og urin
I tillegg bør en forsikre seg om at pasienten bruker medikamentene som forskrevet (behandlingssvikt) og at bivirkninger er fraværende.
Følg pasienten opp hos fastlege og spesialist til sammen med kontroller hver 1-3 måned ved aktiv sykdom og hver 3-6 måned ved stabil tilstand.
Utenom klinisk vurdering er blod- og urinprøver aktuelt: hemoglobin, trombocytter, leukocytter med diff.telling, nyre- og leverfunksjons-tester, CRP og SR. Urin stiks for å utelukke proteiner og/eller erytrocytt-urin (nefritt). For å vurdere ev. sykdomsaktivitet tas anti-DNA og komplement-faktorer (C3 og C4) inntil et par ganger i året. Lipid-profil og glukose måles i blant, særlig hvis behandlingen er intensivert og inkluderer kortikosteroider.
Prognose
Dårlig prognose er assosiert med alvorlig nefritt, hypertensjon, trombocytopeni, pulmonal affeksjon, sentralnervesystem-affeksjon og debutalder over 50 år (sjelden).
Nyrer. Ved nyre-manifestasjon/glomerulonefritt oppnås komplett klinisk og histologisk/immunpatologisk remisjon i bare 20-30% etter 6-12 måneder. Tilbakefall av nefritt ses hos 20-25% etter 3-5 år og 5-10% har alvorlig nyresvikt (end stage renal disease) etter 10 år (Anders H-J, 2020). Enkelte med SLE får varig nyresvikt og behov for transplantasjon. Det er vist like gode resultater av transplantasjon som hos non-diabetikere, selv om subklinisk sykdomsresidiv i nyrer ses hos over 50% (Norby GE, 2009).
Mortaliteten er redusert fra ca. 50% i løpet av 5 år i før-kortikosteroid-tiden (1940-årene) til en overlevelse nå hos 85-95% etter 15 år (Tektonidou MG, 2017). En norsk studie viste 5-års overlevelse på 98% og 10 års overlevelse 95% med standard mortalitetsrate (SMR) på 1,5. Mortalitet ved SLE er bifasisk. Sykdomsforløpet er av betydning: “Jo flere eksaserbasjoner, desto høyere er risikoen for SLE-relatert dødsårsak”.
Dødsårsakene relatert til SLE utgjør 21% av alle dødsfall hos pasienter med diagnosen. Disse årsakene er jevnt fordelt mellom infeksjoner, hjerte-karsykdommer og kreft (Garen T, 2018). I den tidlige sykdomsfase dør pasientene ofte av sykdomsrelaterte årsaker som nefritt, sentralnervesykdom, akutte infeksjoner og myokardinfarkt. Senere i sykdomsforløpet overtar annen kardiovaskulær sykdom og cerebrovaskulære årsaker.
Malignitet. Sannsynligvis er total-forekomsten av maligne sykdommer ved SLE ikke vesentlig økt, men det har vært rapportert økt insidens av cervix-cancer og Hodgkins lymfom.
Retningslinjer, anbefalinger og prosedyrer
EULAR: Fanpouirakis A, 2019 (Management 2019)
EULAR: Fanouriakis A, 2020 (management lupus-nefritt)
EULAR: Andreoli L, 2017 (assistert befruktning)
EULAR: Götestam Skorpen, 2015 (medikamenter ved svangerskap og amming)
ACR (svangerskap): Samaritano LR, 2020
ACR: Hahn BH, 2012 (Lupus nefritt)
Britisk: Gordon C, 2018 (Management)
Norsk revmatologisk forening/legeforeningen (veileder)
Litteratur
- Accapezzato O, 2023 (patogenes og behandling)
- Thomas Dörner, Richard Furie, Lancet 2019
- Lazar S, 2023
- Mok CC, 2018
- Arnud L, 2018 (medikamentutløst SLE)
- Skorpen AC, 2021(Svangerskap)
- Norby GE, 2010 (Lupus nefritt)
- Skomsvoll JF, 2007 (Svangerskap)
- Hanly G, 2018 (CNS-lupus)
