BINDEVEVSSYKDOMMER (REV 021-033)
62 Sjøgrens syndrom (REV 021)
Sjøgrens syndrom
Jan Tore Gran and Øyvind Palm
Kjenntegn på Sjøgrens syndrom
Daglig tørrhet i øyne (xeroftalmi) og i munn (xerostomi).
Kvinner er 10-20 ganger oftere angrepet enn menn.
Nedsatt kjertel-funksjon ved Schirmers test (tåreproduksjon) og sialometri (spytt/saliva).
Forhøyet ANA og SSA (Ro52/60) (ev også SSB (La)) antistoff hos de fleste.
Biopsi av små spyttkjertler fra underleppen kan viser typiske lymfocytt-infiltrater.
Lymfom-risiko i løpet av livet er 5-10%. Lymfopeni og lave komplement C3 og/eller C4 er risikofaktorer.
Diagnosekoder ICD-10: M35.0 (Sjøgrens); R68.2 Tørr munn
Prosedyrekoder: Schirmers test: CCFX05, Sialometri: ELFC00, EKG: FPFE15
Definisjon
Sjøgrens syndrom er en systemisk revmatisk bindevevssykdom som i mer enn 90% av tilfellene rammer kvinner. De fleste diagnostiseres i 40-60 års alder, men symptomene begynner flere år tidligere (Negrini S, 2022). Sykdommen karakteriseres av autoimmun inflammasjon med lymfocytt-infiltrasjon og påfølgende destruksjon av eksokrint glandel-vev (autoimmun eksokrinopati). Skade på kjertlene medfører tørre slimhinner (sicca-symptomer, sicca syndrom) i øyne (xerophtalmi), munn (xerostomi) og underliv. Karakteristisk er også utmattelse/fatigue, leddsmerter og autoantistoff (Gran JT, 1990). Sykdommen kan være komplisert. Omtrent 50% av pasientene får ekstraglandulære manifestasjoner fra bl. a. gastrointestinaltrakten, nervesystemet og lungene. Det foreligger også en 5-10% “life-time” risiko for non-Hodgkins lymfom.
Sekundært Sjøgrens syndrom defineres ved at sykdommen er relatert til en annen autoimmun sykdom, ofte revmatoid artritt, systemisk lupus (SLE) eller systemisk sklerose. (Negrini S, 2022). En sjelden gang rammes barn av Sjøgrens syndrom. Sykdommen kalles da juvenilt Sjøgrens syndrom der symptomene skiller seg noe fra den voksne formen (Ramos-Casals M, 2021).
Historie
Henrik Samuel Conrad Sjögren (1899-1986) var svensk oftalmolog og beskrev sykdommen («Keratokonjunktivitis sicca») i 1933 blant 19 kvinnelige pasienter med tørre øyne og munn, hvorav 2/3 også hadde artritt (Sjogren H, 1971). Tilfeller var imidlertid beskrevet allerede på 1800-tallet (WB. Hadden, On dry mouth or suppression of the salivary and buccal secretions, Trans. Clin. Soc. Lond. 21, 1888, 176–179). Sjøgrens sykdom ble tidligere omtalt som en benign form av systemisk lupus (SLE) med et mildere sykdomsforløp enn de andre systemiske bindevevssykdommene (J.M. Heaton, 1959). Selv om prognosen generelt er bedre enn ved SLE, viser studier at også pasientene med Sjøgrens syndrom kan ha manifestasjoner i flere organer og betydelig påvirket livskvalitet (Rusten S, 2017).
Sekundært Sjøgrens syndrom
Ved sekundært Sjøgrens syndrom foreligger en annen inflammatorisk autoimmun sykdom samtidig (Theander E, 2008). Hos 90 % utvikles den primære sykdommen slik som revmatoid artritt, systemisk lupus (SLE) eller systemisk sklerose først. Sekundært Sjøgrens syndrom er vanligst ved revmatoid artritt og SLE, der forekomsten er ca. 20%. Sekundært Sjøgrens syndrom er heller ikke uvanlig ved systemisk sklerose.
Overlappsyndrom. I noen tilfeller er en i tvil om Sjøgrens syndrom er den primære eller sekundære tilstanden. I praksis velger en en tilstanden med de mest fremtredende sykdomsmanifestasjonene og typisk antistoff-mønster som den primære diagnosen. Dersom to eller flere autoimmune sykdommer er ganske likt fremtredende og multiple antistoff foreligger, kan tilstanden også defineres som et overlapp-syndrom eller uspesifikk systemisk bindevevssykdom.
Epidemiologi
Sjøgrens syndrom er den vanligste av de systemiske bindevevssykdommene. Kvinner angripes 10-20 ganger vanligere enn menn, og sykdommen er beskrevet blant alle raser. Prevalens i befolkningen er 0,05-1 % (Göransson LG, 2011). Sykdommen er dermed på grensen til å defineres som en sjelden sykdom (1/2000 personer, 0,05%) (Cornec D, 2015).
Blant pasienter med sicca-symptomer påvises Sjøgrens syndrom hos 5-15 %. Vanligst diagnostiseres sykdommen i 40-60 års alder, men symptomene begynner flere år tidligere (Negrini S, 2022). Antistoffene SSA (Ro 52/60) og SSB (La) kan ofte observeres flere år før symptomene. Sykdomsdebut er før 31 års alder hos 15%. Sykdommen er rapportert også hos barn (oftest 3-9 år) i form av juvenilt Sjøgrens syndrom (Ramos-Calsals M, 2021).
Genetikk
Primært Sjøgrens syndrom er assosiert med HLA DR3, DQ1 og DQ2, mens Sjøgrens syndrom sekundært til RA er koblet med HLA DR 4. Sjøgren sekundært til SLE er assosiert med HLA DR2, DR3. Sykdommen er ikke sterkt arvelig. Familiær forekomst er omkring 5 % (Harris WM, 2019).
X-kromosomatiske genetisk forhold og hormoner må også antas å være av betydning blant de mange kvinner som rammes (Miquel C-H, 2023).
Epigentiske faktorer er vist å være av betydning i autoimmune sykdommer. Ved Sjøgrens sykdom kan epigenetiske faktorer regulere interferon, mikro-RNA signaler og genetiske loci som er ansvarlige for antigen presentasjon og dermed bidra til utvikling av sykdommen (Cole MB, 2016).
Etiologi og patogenese
Virus. Sykdomsårsaken (etiologi) er ukjent og sannsynligvis multifaktoriell. Utenom genetisk disposisjon (se ovenfor) kan virus være av betydning. Mus infisert med retrovirus utvikler Sjøgren-liknende sykdom. En ny interesse for mulig assosiasjon med Epstein-Barr virus foreligger etter at deler av virus (miR-146a og BART155) ble funnet i kjertelbiopsier, og det er holdepunkter for at ekstracellulært miRNAs kan stimulere det innate immunsystemet via interferon tidlig i sykdomsutviklingen (Shimiu T, 2021: Luo X, 2013).
B-celler. Patogenetisk dominerer CD4+ T-hjelper celler i spyttkjertler, men sykdommen ses på som en B-lymfocytt drevet autoimmun sykdom der det adaptive immunsystemet er sentralt (Chivasso C, 2021). Noen av B-cellene i vevet produserer antistoff rettet mot eget vev (autoantistoff). Som tegn på B-celleaktivering er IgG i serum ofte forhøyet. Kjertelvevet destrueres gjennom cellemedierte mekanismer: produksjon av autoantistoff interfererer med muskarin reseptorer og sekresjon av metalloproteinaser forstyrrer interaksjonen mellom celler og ekstracellulær matriks, samt sekresjon av cytokiner. Interferonsystemet er aktivert, og B-celle aktiverende faktor (BAFF) er oppregulert, noe som kan hemme apoptose av autoreaktive B-celler (Mavragani CP, 2013). Aquaporin-5 (AQP5) i spyttkjertlenes epitelceller kan være mål for den autoimmune prosessen (Matsozaki T, 2012), og B-lymfocytt-infiltrasjon i spyttkjertler kan medføre epitelcelle apoptose (Varin M-M, 2012). Det histologiske bildet er en progressiv fokal infiltrasjon av mononukleære lymfoide celler som fortrenger kjertelepitelet (lymfoepiteliale lesjoner).
Symptomer og kliniske uttrykksformer
Hovedmanifestasjonene er daglig tørre øyene og munntørrhet, noe som rapporteres av 98% av pasientene. Både tørre øye og tørr munn rammer 89% (Baldini C, 2014). Økt tretthet/søvnbehov og artralgier er også vanlig. Indre organer angripes hos ca. 25%, men oftest uten store konsekvenser. Non-Hodgkins lymfom er imidlertid en potensielt alvorlig komplikasjon (Carsons SE, 2023).
Artralgier: Leddsmerter ses hos over 70 % (Baldini C, 2014). Omkring 1/5 har samtidig fibromyalgi.
Artritt forekommer hos 10% (Ramos-Casals M, 2013) oftest i små ledd. Det er uvanlig med usurerende radiografiske forandringer dersom det ikke foreligger en overlappstilstand med revmatoid artritt.
Cystitt: Interstitiell cystitt (dysuri) forekommer hos 7% og medfører hyppig vannlating / cystitt-symptomer, men uten funn av bakterier (Susgai S, 2004).
Fatigue/ tretthet: Ofte er utmattelse (fatigue) uttalt, dominerende og pasientene opplever økt søvnbehov. De sover mye, men blir ikke uthvilte. Symptomet er meget behandlingsresistent. Ingen medikamenter har vist sikker effekt. Tilpasset fysisk aktivitet og trenging anbefales. Hyppige oppvåkninger på grunn av smerter ved fibromyalgi-lignende symptomer eller urinering flere ganger om natten på grunn av høyt væskeinntak og kan også bidra til tretthet (Mæland E, 2021).
Lymfeknuter. Forstørrede lymfeknuter, særlig på halsen er et veldig vanlig og oftest ufarlig symptom ved Sjøgrens syndrom. Vedvarende hevelse må skilles fra lymfom (se nedenfor).
Munntørrhet: Munntørrhet (Xerostomi) er tilstede hos 98 %. Økt karies, særlig omkring tannhalsen. Proteser kan løsne. Oral candidiasis hos opp til 75 %. Munntørrhet kan til en viss gar objektiveres ved sialometri (se Undersøkelser nedenfor).
Gastrointestinale manifestasjoner: Gastrointestinale manifestasjoner av ulik art observeres hos opp til 80% av pasientene. Årsakene er flere. Redusert mengde gastrointestinale væske med enzymer fra spytt, pankreas og andre gastrointestinale glandler er ugunstig for fordøyelsen. Øsofagusdysfunksjon (Obs! overlapp med systemisk sklerose og myositt) forekommer hos enkelte og kan skyldes autonom nevropati (Negrini S, 2022). Svelgevansker skyldes oftere tørrhet i svelget. Gastritt, kronisk atrofisk, hepatitt (kronisk, autoimmun), pankreatitt (subklinisk), pernisiøs anemi med rhagader, primær biliær cirrhose, watermelon stomach (Gastrisk Antral Vaskulær Ektasi, GAVE : Obs! overlapp med systemisk sklerose) er sjeldne komplikasjoner. Ved gastrointestinale symptomer bør en også ha i mente at opp til 15% av pasientene også har cøliaki (Popov Y, 2018).
Genitalier: I genitalier sees vaginal sicca og moniliasis (candida).
Hematologisk (se tabell nedenfor)
| Variabler i blodet (Ramos-Casals M, 2013) | Inaktiv sykdom | Aktiv sykdom | p-verdi |
| Anemi | 11% | 18% | 0.022 |
| Leukopeni | 9% | 22% | <0.001 |
| Neutropeni | 0,6% | 14% | <0,001 |
| Lymfopeni | 5% | 13% | <0,001 |
| Lavt C3 nivå | 5% | 10% | 0,03 |
| Kryoglobulinemi | 6% | 13% | 0.032 |
Huden: Huden er ofte plagsom tørr (xeroderma). Palpabel purpura (vaskulitt) gir lesjoner hos 10%, oftest på underekstremitetene, gjerne utløst av fysisk aktivitet. Purpura kan etterlate kosmetisk skjemmende hyperpigmentering (hemosiderin, jern). Erythema annulare kan være uttalt, korrelert med SSA/B antistoff og symptomene overlapper med subakutt kutan lupus (Negrini S, 2022).
Lever. Lett forhøyede leverenzymer ses hos opp til 50% med Sjøgrens syndrom. Imidlertid er det bare en minoritet av dem som har primær biliær cholangitt, autoimmun hepatitt, non-alkoholisk fettlever eller annen spesifikk leversykdom (Negrini S, 2022).
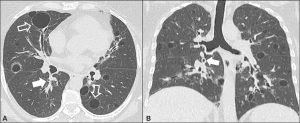
Lunger/luftveier. Diffus interstitiell lungesykdom med tørrhoste og dyspné, samt påvirket HRCT eller lungefunksjon ses klinisk hos opptil 25 % (Palm O, 2013). Ved systemiske undersøkelser (lavage, CT, lungefunksjonstester) kan imidlertid patologiske luftveisfunn gjøres hos opp til 85%. I øvre luftveier kan pasientene plages av tørrhet med skorper i nesen, neseblødning og sinusitt. Kronisk heshet er vanlig (opp til 50%) og kan skyldes tracheal sicca med tørrhoste. I lungene kan tørrhet også disponere for atelektase, bronkiektasier og dermed residiverende luftveisinfeksjoner (Stojan G, 2013). Bronkiolitt, hovedsakelig follikulær type) er regnet for å være vanligste manifestasjon i distale luftveier (Flament T, 2016). Residiverende bronkitter og pneumonier samt pulmonal fibrose kan være følgetilstander. Andre lungemanifestasjoner er interstitiell lungesykdom i form av non-specific interstitial pneumonia (NSIP), organisert pneumoni, kryptogen organiserende pneumoni og den karakteristiske lymfocytær interstitiell pneumoni (LIP). -Lymfoid interstitiell pneumoni (LIP) er en ikke sjelden interstitiell lungesykdom ved Sjøgrens syndrom. Den er er karakterisert ved til dels store tynnveggede cyster med diffus hyperplasi av bronkialt assosiert vev, progressiv hoste og dyspné. Fem års mortalitet er beskrevet å være hele 35-50 %, men dette gjelder trolig selekterte tilfeller. Omtrent 5 % transformeres til lymfom (Swigris JJ, 2002).Vennligst les om lunger og revmatisk sykdom i eget kapittel
Muskler: Myositt påvises hos ca. 2 % og er vanligvis asymptomatisk med bare lett økte CK-verdier (Colafrancesco S, 2015). Også hypokaliemi ved renal affeksjon kan medføre muskelsymptomer. Vanligste årsak til muskelsmerter er likevel komorbiditet i form av fibromyalgi (Choi BY, 2016).
Malignitet i form av non-Hodgkins lymfom lokaliseres bade intra- og ekstraglandulært. Omkring 50 % ses i spyttkjertlene, mens gastrointestinalkanalen, lunger, hud, tymus og thyreoidea affiseres sjeldnere. Lymfomene er typisk lavgradig MALT lymfom (Mucosa Assosiert Lymfoid vev (Tissue). Nodal marginal sone lymfom og diffus store B-celle lymfomer utgjør en mindre del. Bare 10% av lymfomene utvikler seg til mindre differensierte og mer aggressive former (Nocturne G, 2015). Lymfom-utvikling forekommer 4,3-16 ganger hyppigere ved Sjøgrens syndrom enn i normalbefolkningen. Komplikasjonen kan komme når som helst i sykdomsforløpet. «Life time risk» er estimert til 5-10%, forutsatt at de fyller US/EU kriterier for Sjøgren-diagnosen (Alunno A, 2018; Solans-Laque R, 2011). Symptomer på lymfom: Vedvarende lokalisert hevelse oftest i spyttkjertel eller på hals, men også andre lokalisasjoner må vurderes: Nattesvette, feber, vekttap og påvirket allmenntilstand. Fall i gammaglobulin (IgG), utvikling av monoklonalt protein. Nyoppstått leukopeni (lymfopeni). Bortfall av tidligere autoantistoff. Andre prognostiske faktorer er: Gjennomgått parotitt, palpabel purpura, lymfopeni ved diagnosetidspunkt, mulig økt risiko for lymfom hos de pasientene som i leppebiopsi far påvist ektopiske germinale sentre. Aktuelle symptomer og risikofaktorer (se nedenfor) bør tas hensyn til i oppfølgingen av pasientene, selv om det ikke foreligger klare retningslinjer for dette (Negrini S, 2022).
Nevrologiske manifestasjoner (“nevro-Sjøgrens”) forekommer hos opp til 20 % med Sjøgrens. De kan debutere før sicca-symptomene og er oftest langsomt progredierende. Nevrologiske manifestasjoner omfatter både det perifere nervesystemet (vanligst) med sensorisk nevropati og CNS-symptomer (sjeldnere) med ataktisk nevronopati eller Multiple sklerose (MS) -lignende tegn (Topon GJ, 2012; Berkowitz A, 2014).
-Perifer nevropati kan deles videre inn i sensorisk nevropati med eller uten tynnfibernevropati. Både mononevritt og polynevropati forekommer Pavlakis PP, 2012). Ved tynnfibernevropati foreligger ofte dysestesi, parestesi, overømfintlighet (allodyni) og hyperalgesi. Vanlige elektrofysiologiske undersøkelser fanger vanligvis ikke opp tynnfibernevropat, slik at tynnfibernevrografi eller biopsi (redusert tetthet av epidermale nervefibre) kan være nødvendig for å sikre diagnosen (Gwathmey KG, 2021).
-CNS nevropati omfatter sensorisk ataktisk nevronopati som er relatert til de dorsale nerverøttenenerverøttene ved ryggmargen. Konsekvensen er svekket følelse for bevegelse med ataksi, ustø halting, hyporefleksi og autonom nevropati (gastrointestinalt). Utenom ryggmarg kan også hjernestamme, nervus opticus, cerebellum og cerebrale hemisfærer påvirkes (Topon GJ, 2012; Berkowitz A, 2014). Forekomst av nevromyelitis optica (NMO) og transvers myelitt ved Sjøgrens er også rapportert (Shabeer P, 2021). I tillegg ses tilfeller med kognitiv svikt i form av redusert konsentrasjon, oppmerksomhet og hukommelse er et vesentlig problem som korrelerer med sykdomsaktiviteten (Seeliger T, 2020). CNS symptomer kan isolert sett lett feiltolkes som multiple sklerose (Jung SM, 2000; Cojocaru IM, 2011).
Nyrer. Prevalensen av nyresykdom relatert til Sjøgrens er angitt til ca. 5%, men er trolig underestimert (Ramos-Casals M, 2015). Kronisk tubulointerstitiell nefritt er vanligste form og da i form av distal (type1) renal tubulær acidose (Francois H, 2016).
-Glomerulonefritt er uvanlig og bør differensialdiagnostisk tilsi vurdering på mulig systemisk lupus (SLE). Interstitiell cystitt er beskrevet ovenfor.
–Renal Tubulær Acidose er oftest asymptomatisk, og innebærer manglende evne til å surgjøre urinen. PH i urinen forblir i alkalisk område. Kombinasjonen av hypokalemi, positivt aniongap i urinen, høy urin-pH og en hyperkloremisk metabolsk acidose er diagnostisk for distal renal tubulær acidose. Oftest dreier det seg om en ukomplett type uten syre-base endringer i perifert blod, men hypokaliemi med pareser er rapportert (Gøransson LG, 2000). Residiverende nyresten og kalkutfelling i nyrene ses sjelden. Renal tubulær acidose kan undersøkes ved furosemid-test. Dersom en vanlig stiks viser sur urin (pH), er det ikke nødvendig med denne utredningen. Bestem pH i morgenurin og blod, samt kreatinin og kalium. Gi 40 mg furosemid per os. Alle urinporsjoner de etterfølgende 6 timene analyseres for pH, kalium og kreatinin. Hos friske faller pH til under 5,3, og kalium-utskillelsen øker. Testen er tidkrevende og er nå mer og mer erstattet av citrat/kreatinin ratio.
Pankreas er et eksokrint organ som også kan affiseres. Klinisk pankreatitt er likevel en uvanlig komplikasjon (Hedstrøm A, 2022).
Parotishevelse kommer og går hos ca. 50% av pasientene. Begge sider affiseres, men ikke nødvendigvis samtidig. Vedvarende hevelse må vurderes nærmere for å utelukke lymfom (Rischmueller M, 2016).
Raynauds fenomen: Raynauds fenomener forekommer hos 10-20 %. Vær da spesielt oppmerksom på overlapp med systemisk sklerose (Ramos-Casals M, 2008).
Thyreoidea: Autoimmun thyreoiditt / hypothyreose er funnet å forekomme hos omkring 20 % med Sjøgrens syndrom basert på en italiensk multisenter studie med mer enn 2500 pasienter (Colafracscesco S, 2023). Autoimmun thyreoiditt er da også vanligste autoimmune comorbiditet, selv om også økt forekomst av revmatoid artritt og systemisk lupus (SLE) forekommer som del av polyautoimmunitet (Anaya J-M, 2016).
Øye-manifestasjoner opptrer som følelse av tørrhet (Xeroftalmi), rusk, irritasjon, tilbakevendende betennelser og gjenklistring om morgenen. Initialt kan økt tåreflom ses (paradoksal xeroftalmi). Keratitt med “dry spots” som er punktformede defekter på sklera der hornhinnen blir dårlig dekket av tårefilmen. Mens tårekjertler produserer tårevæsken, bidrar Meibomske kjertler (på kanten av øyelokkene) for optimal smørende kvaliteter ved sekresjon av lipider og proteiner (Bjordal O, 2020).
Juvenilt Sjøgrens syndrom: Barn har få eller ingen symptomer, men hovne parotis-kjertler, utslag i SSA/B antistoff og høy IgG er vanlig. Typiske funn ved ultralyd, MR eller histologiske undersøkelser av spyttkjertler (Ramos-Casals M, 2021). Juvenilt Sjøgrens syndrom er omtalt in et eget kapittel.
Undersøkelser
Anamnesen ved Sjøgrens syndrom kartlegger symptomer på daglig tørrhet eller irritasjon i øyne som følelse av rusk eller sand, bruk av kunstig tårevæske flere ganger (x3?) daglig, tørr munn hele dagen og må drikke for å svelge tørre matvarer, parotitt, lymfeknuter, artritt, purpura, nevropati, utmattelse. Andre årsaker som medikamenter (antihistaminer, antidepressiva, betablokkere, diuretika, parkinsonmedikasjon), kjent sarkoidose, hepatitt C, bestråling). B-symptomer med nattesvette, feber, vekttap. Symptomer fra lunger, mage-tarm, perifere nerver, hjertet. Raynauds fenomen.
Klinisk kan en utenom en generell undersøke, inspisere øyne (røde, irriterte), munn (tørre slimhinner), hals (lymfeglandler), parotiskjertler (50% har forstørrede kjertler, OBS! tumorer), submandibularis-glandler, hud (purpura, eksem), nevropati distalt. Ved auskultasjon av lunger kan ILD og fibrose-tegn avdekkes ved krepitasjoner. Hjerterytme, blodtrykk, bilyder over hjerte og lunger utelukkes. Huden inspiseres for purpura, særlig på begge legger og annet eksantem.
-Sialometri: Spyttfunksjonen testes med ustimulert sialometri. Spyttmengden som naturlig kommer i munnen samles over 15 minutter. Totalt 1,5ml eller mer er normalt. Testen krever godt samarbeid med pasienten. Svelging av spytt medfører for lave verdier. Pasienten skal ikke ha ikke spist eller drukket på minst 60 minutter før sialometri (Kalk WW, 2001).
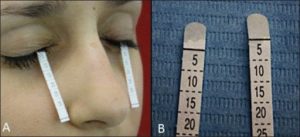
-Schirmers test: Tåreproduksjonen testes med Schirmers test. Sannsynlig patologisk < 10 mm/5 min: Sikker patologisk < 5mm i minst ett øye). Pasientene skal ikke ha brukt kunstig tårevæske samme dag som testen gjøres (Beckman KE, 2016).
-Tear Break up Time: Her måles tiden det tar for tårefilmen oppløses. (patologisk < 10 sek.) (Beckman KE, 2016).
-Rose Bengal farging og van Bijsterveld score: måler skade på cornea («Dry spots»).
Laboratorieprøver. Rutineprøver kan omfatte CRP, SR, Hb, leukocytter med differensialtelling, trombocytter, elektrolytter, lever-, nyre- og thyreoidea-funksjonsprøver, LD, amylase eller lipase, kreatin kinase (CK), glukose, IgG og proteinelektroforese, komplementfaktorer C3 og C4 og urinstiks. Initialt er også ANA med SSA (Ro 52 og Ro60), SSB og kryoglobuliner aktuelt. Differensialdiagnostisk kan ACE (angiotensin Converting Enzym ofte økt ved sarkoidose) og antistoff mot hepatitt C være aktuelt. urin stiks (inkluderer PH). Antistoff-prøver: vennligst se nedenfor.
Immunologiske prøver. Revmatoide faktorer (RF) ses hos 70 – 90 %, men er uspesifikk. Anti-CCP antistoffer kan påvises hos 7,5 % av pasienter med Sjøgrens syndrom (Obs! sekundær Sjøgrens til RA eller Sjøgrens-RA overlapp syndrom). Antinukleære antistoff (ANA) hos omkring 60 %. Subspesifisitetene anti-SSA (Ro 52/60) og anti-SSB (La) er relativt spesifikke for Sjøgrens syndrom. Det finnes to typer anti-SSA antistoff: 52 kDa og 60 kDa. Anti-mitokondrie antistoff (primær biliær kolangitt) påvises hos 10 % og anti-parietal-celle antistoff (intrinsic faktor/ B12 opptak/pernisiøs anemi) hos 15 %.
Bildediagnostikk
-CT og HRCT brukes for å vurdere ev. pulmonale forandringer. Vanligvis begrenses undersøkelser til pasienter med symptomer, selv om en del asymptomatiske tilfeller vil kunne påvises ved “screening”. Ved påvist lunge-manifestasjon anbefales kontroll av forandringene innen 3-6 måneder for å avgjøre om de er progredierende, noe som kan ha terapeutiske konsekvenser (Lee AS, 2021).
MR av hals med parotis eller submandibularis ved mistanke om malignitet, fortrinnsvis etter ultralyd-vurdering.
–PET/CT brukes diagnostisk ved mistanke om lymfom eller annen malignitet.
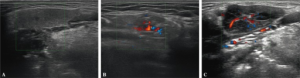
-Ultralyd av spyttkjertler (ultralyd av parotis) kan påvise patologiske forandringer (Ramsubeik K, 2020) og øke diagnostisk sensitivitet og spesifisitet (JousserJoulin S, 2020; Martel A, 2018).
Ultralyd skår spyttkjertler (Referanse: Hocever A, 2005):
- Parenkymal ekkogenitet sammenlignet med thyreoidea, score 0-1
- Homogenisitet, score 0-3
- Hypoekkogene områder score 0-3
- Hyperekkogene reflekser
- Parotis score 0-3
- Submandibularis score 0-1
- Distinkt kjertelgrense score 0-3
Biopsi. Forandringer ved biopsi av små spyttkjertler fra leppens innside (Lower Lip Biopsy). For å definere sialoadenitt ved leppebiopsi kreves lymfocyttinfiltrasjon av betydelig grad med foci, evt. atrofi og destruksjon av kjertelelementer (Fokus score minst 1,0 hvor fokus defineres som ansamling av minst 50 mononukleære celler) (Guelle D, 2013).
–Seleksjon av pasienter til biopsi: Minstekravet er redusert Schirmers test sammen med minst et annet tegn på eksokrin dysfunksjon (sialometri, parotitt, positiv Rose Bengal, nedsatt Tear Break-up time) eller symptomer sammen med anti-SSA/SSB antistoffer.
-Komplikasjoner etter biopsi. En italiensk studie fant at 10 av 50 pasienter (20%) som gjort pyttkjertelbiopsi fra underleppen hadde lokalt ubehag etter inngrepet. Tre (6%) rapporterte sensorisk defekt på biopsistedet opp til noen få uker. Tre (6%) følte såpass smerte at de brukte analgetika, mens en hadde forbigående brennende følelse i et par dager. Tre pasienter (6%) hadde et hematom i leppen og hos to forelå tegn til mild inflammasjon på biopsistedet (Varoni EM, 2020).
-Hudbiopsi for å påvise vaskulitt, purpura, annen hudsykdom eller tynnfibernevropat kan være nødvendig for å sikre diagnosen i spesielle tilfeller.
Beregning av fokus-score basert på biopsi fra underleppe ved Sjøgrens syndrom. Det må foreligge 2-4 små kjertler slik at overflaten som mikroskoperes er på minst 8 kvadratmillimeter (referanse: Fisher BA, 2017)
- Små spyttkjertler blir undersøkt i biopsi fra leppen
- Antall foci (ansamlinger) med mer enn 50 lymfocytter blir summert
- Arealet som blir vurdert blir beregnet
- Antall foci (n) delt på overflate-arealet (a) blir multiplisert med 4 = foci-score
Formel n : a x 4 =
- Verdi 1,0 eller høyere kan tyde på Sjøgrens syndrom, men er ikke diagnostisk.
- Røkere har lavere score enn ikke-røkere.
- Falske positive forekommer for eksempel etter skade (bitt) på leppen
Diagnose
En generell klinisk undersøkelse bør omfatte inspeksjon av øyne, munnhule, hud, auskultasjon av hjerte og lunger, palpasjon av abdomen, parotis og glandel-stasjoner, leddundersøkelse.
Det finnes flere diagnostiske kriterier, men uansett hvilke man velger å bruke, bør endelig diagnose samsvare med sykdomsdefinisjonen. Det er derfor rimelig å kreve at objektive tegn på eksokrin inflammasjon og/eller autoimmunitet skal kunne påvises. Dette innebærer at det skal påvises objektive tegn til nedsatt spytt- og/eller tåreproduksjon, samt auto-antistoffer og/eller positiv spyttkjertelbiopsi.
Klassifikasjonskriterier 2016
ACR/EULAR kriterier baseres på personer med tørrhet og/eller andre Sjøgren-suspekte symptomer* (Shiboski CH, 2016)
Fokusskår (biopsi) minst =1 foci/4 kv.mm 3 poeng
Positiv anti-SSA (Ro) antistoff: 3 poeng
Farge-skår/hornhinner minst 5 i minst ett øye
(eller van Bijsterveld skår minst 4): 1 poeng
Schirmers test 5mm/5 min eller lavere, minst ett øye: 1 poeng
Ustimulert sialometri 0,1ml/min ≤ 1,5ml/15min: 1 poeng
- Minst 4 poeng=Sjøgrens syndrom
- I praksis må enten anti-SSA eller positiv vevsprøve foreligge
*Minst ett positivt svar på følgende 5 spørsmål:
- Har du hatt daglig, vedvarende plagsomme tørre øyne i minst tre måneder?
- Har du hatt gjentakende følelse av sand eller grus i øynene?
- Bruker du kunstig tårevæske minst tre ganger daglig?
- Har du hatt daglig følelse av tørr munn i minst tre måneder?
- Må du ofte drikke for å svelge tørre matvarer?
Eksklusjon: Tidligere stråleterapi mot hode/hals, Aktiv hepatitt C-infeksjon, AIDS-infeksjon, Sarkoidose, Amyloidose, Graft-versus Host Disease, IgG4-relatert sykdom
Bruk av spesielle medikamenter, anti-kolinerge medikamenter, som forårsaker tørrhet skal stanses i god tid før måling av tåre- og spyttkjertel-funksjon
Differensialdiagnoser
- Aldersbetinget kjerteldegenerasjon
- Amyloidose
- Burning mouth syndrom
- Diabetes mellitus
- Hepatitt C
- HIV-relatert diffus infiltrativ lymfocytose syndrom (DILS)
- Hyperlipidemi, Type V
- Hypothyreose
- IgG4-relatert sykdom
- ME, kronisk utmattelsessyndrom
- Medikamenter som medfører tørrhet (oftest munntørrhet) og økt tretthet. Hyppigste årsak til munntørrhet
- Sarkoidose
- Stråle-skader (tidligere kreft-behandling)
- Vitamin-A mangel (øyne)
“Dry eyes and mouth syndrome”: En betegnelse som benyttes av noen for å beskrive pasienter med Sjøgren syndrom-liknende symptomer og funn, men med negativ biopsi. Noen av disse likner mer på Fibromyalgi. Noen har funnet anti-thyreoid peroksidase antistoffer (anti-TPO) hos 60% av slike pasienter. Spyttkjertelbiopsi kan vise mild interstitiell inflammasjon.
Normal tåreproduksjon (normal Schirmers test)
- Miljøfaktorer
- klima-anlegg, røking, arbeid ved PC
- Dysfunksjon i Meibomske kjertler, rosacea.
- Kontaktlinser.
- Cornea hypoestesi etter laserkirurgi (laser in-situ keratomileusis) eller diabetes
- Inkomplett lukning av øyne.
Redusert tåreproduksjon (unormal Schirmers test)
- Medikament-indusert
- Antikolinerge, antihistaminer, tricykliske antidepressiva, diuretika.
- Alders-relatert/menopause.
- Strålebehandling mot hode/ansikt i anamnesen.
- Kronisk viral infeksjon (HCV, HIV).
- Sarkoidose
- Non-Hodgkins lymfom.
- IgG-4 relatert sykdom.
Tørr munn (xerostomi)
- Medikament-indusert
- Antikolinerge, antihistaminer, tricykliske antidepressiva, diuretika, antihypertensive legemidler.
- Angst-tilstander
- Endogen depresjon
- Fibromyalgi
- Bulimi/anoreksi (ofte også store parotis-glandler)
- Strålebehandling mot hode/hals i anamnesen.
- Systemsykdom
- Sarkoidose, amyloidose, HCV*, HIV.
Parotis-hevelse
Unilateral, akutt hevelse; Bakteriell infeksjon, aktinomykose, mekanisk obstruksjon ved spyttkjertelsten i ductus.
Unilateral kronisk hevelse: ‘Kronisk sialoadenitt, kreft (pleiomorft adenom).
Bilateral kronisk hevelse: Viral infeksjon*: Kusma, EBV, CMV.
Bilateral kronisk hevelse: Kronisk infeksjon*: HCV, HIV. Diabetes. Alkoholisme. Anoreksi. Amyloidose. IgG4 relatert sykdom. Hyperlipoproteinemi.
*CMV: cytomegali-virus, EBV: Epstein-Barr-virus, HCV: hepatitt-C virus
Skåring av sykdomsaktivitet: ESDAI (Legen fyller ut), ESPRI (Pasienten skårer selv)
Svangerskap
En fransk studie av 54 svangerskap blant 19 kvinner med Sjøgrens syndrom viste økt antall spontanaborter, litt økt antall dødfødsler og fødeterminen var i gjennomsnitt en uke for tidlig sammenlignet med friske kontrollpersoner (Ballester C, 2017). Økt generell risiko foreligger i de tilfeller der sykdommen angriper nyrer (interstitiell nefritt, renal tubulær acidose), lunge eller hjerte. De vanligste komplikasjonene er likevel relatert til SSA og SSB antistoff som ses hos de fleste (se nedenfor) (Gupta S, 2017).
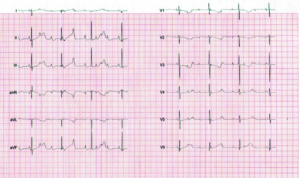
SSA og SSB antistoff: Ved Sjøgrens syndrom, enkelte med SLE (se ovenfor) og annen forekomst av antistoffene SSA og SSB passerer disse placenta og kan medføre føtal hjerteblokk hos foster i ca. 2% av tilfellene. Dette skjer mellom svangerskapsuke 16 og 26 (Andreoli L, 2017; Samaritano LR, 2020). Regelmessig registrering av fosterets hjertefrekvens anbefales derfor, vanligvis via jordmor eller fastlege. Amerikanske retningslinjer anbefaler å starte kontrollene fra svangerskapsuke 16-18 og avsluttes etter uke 26, mens europeiske retningslinjer, inklusiv de norske fra Gynekologisk forening, anbefaler kontroller fra uke 16 til og med svangerskapsuke 24 (Samaritano LR, 2020; Andreoli L, 2017; Veileder Gynekologisk forening). Dersom for lav hjertefrekvens (<110/min) påvises, må videre utredning gjøres av spesialavdeling med tanke på støttende medikasjon under svangerskapet og fordi forberedelse for pacemaker ved fødsel kan være aktuelt. Det er imidlertid omdiskutert om deksametason (4mg per oralt/dag) ved hjerteblokk grad 1-2 kan hindre utvikling til grad III. Dessverre observeres at ca. 20% av fostre med hjerteblokk grad III dør intrauterint eller i første leveår, mens ca. 50% av levende fødte vil ha behov for pacemaker (Samaritano LR, 2020). Gynekologisk forening anbefaler at alle barn av mødre med SSA/B antistoff undersøkes med EKG før de forlater barselavdelingen (Veileder i fødselshjelp pr juni 2021). Dette for å oppdage inkomplett hjerteblokk. Hydroksyklorokin (Plaquenil) kan virke forebyggende mot kongenital hjerteblokk, særlig blant dem som har hatt svangerskap med slik komplikasjon tidligere (Izmirly P, 2020). Etter fødsel får ca. 10% blant barn av mødre med SSA/B antistoff et lupus-lignende utslett (neonatal lupus). Årsaken er antistoffene overført fra mor. Dersom blodprøver undersøkes, veil en kunne finne transistente cytopenier hos ca. 20% og lett forhøyede transaminaser hos ca. 30% (Wahren-Herlenius M et al Dubois’ lupus erythematosus and related syndromes. 8th ed. Philadelphia: Saunders; 2012. p. 464–72). Når barnet i løpet av noen måneder kvitter seg med antistoffene, forsvinner utslettet og de øvrige forandringene. En kontroll av hematologiske parametere med celletellinger hos spebarn ved 3 måneders alder kan være aktuelt. Ved 9 måneders alder er symptomene vanligvis gått helt tilbake (Zuppa AA, 2017)- Barn som får lysbehandling (på grunn av ikterus) er spesielt utsatt for eksantem. Vennligst se også informasjon fra NKSR angående gravide med SSA/SSB antistoff.
Behandling
Behandlingsmålet ved Sjøgrens sykdom er vanligvis å lindre symptomene og redusere risiko for komplikasjoner. Kurativ behandling mangler.
Tørre øyne:
- Profylaktisk og symptomatisk behandling med kunstige øyedråper (Viscotears, Oculec, Artelac med flere) bør brukes hyppig. Gel (Viscotears) brukes mest om kvelden.
- Dersom dysfunksjon i Meibomske kjertler foreligger kan midler mer fettstoffer være nyttig (Cationorm, Systane Balance, Oxyal Triple Action, Tearsagain øyespray). Disse er dessverre ikke på blå resept (pr 2022).
- Øyedråper med antiflogistika (NSAIDs) bør ikke brukes lenger enn 2-4 uker for ikke å skade cornea.
- Plugging av tårekanalen kan forsøkes, men er sjelden vellykket på sikt.
- Ciclosporin øyedråper (Ikervis) har effekt hos enkelte og forskrives av øyelege initialt.
Tørr munn. For den reduserte spyttfunksjonen er følgende aktuelt:
- God munnhygiene er viktig for a motvirke karies
- Bruk fluortannpasta som ikke skummer (Zendium)
- Stimuler spyttsekresjonen med sukkerfrie sugetabletter
- Rengjøring av tenner og bruk av fluor etter hvert måltid
- Unngå søtsaker
- Drikke rikelig
- Fast kontroll hos tannlege med interesse for Sjøgrens syndrom
Dokumentert virkning av forebyggende behandling (for personer med mistenkt Sjøgrens sykdom under utvikling) foreligger ikke.
Tørr hud kan behandles med fuktighetskremer
Tørr skjede kan behandles med østrogenkrem.
Pankreas-insuffisiens vurderes av gastroenterolog ved behov. Pankreas-enzymer (Creon) kan forsøkes.
Systemisk behandling (Forslagene er oppdatert etter EULAR, Ramos-Casals M, 2019)
Hydroksyklorokin (Plaquenil) forsøkes i blant ved: 1) Artritt/synovitt. 2) Diffust annulært erythem. 3) For å forebygge neonatal lupus i svangerskap blant SSA og/ eller SSB positive gravide. Effekt på tørrhet eller utmattelse/fatigue er ikke vist.
Kortikosteroider. Kortikosteroider (Gc) som lavdose prednisolon – ev. kortvarig høyere dose – kan forsøkes ved enkelte komplikasjoner: Akutte glandulære manifestasjoner forutsatt at andre årsaker er utelukket. Ved polyartritt / synovitt kan kortikosteroider brukes, ofte kombinert med hydroksyklorokin. Diffust annulær erythem eller kutan vaskulitt kan være indikasjoner for glukokortikoid. Interstitiell lungesykdom (ILD). Nyremanifestasjoner (tubulær eller glomerulær). Nevrologiske komplikasjoner som perifer nevritt eller CNS-affeksjon. Hematologiske manifestasjoner (trombocytopeni < 20.000 eller hemolytisk anemi).
csDMARDs (utenom hydroksyklorokin) velges i noen tilfeller. Indikasjoner: Artritt / synovitt (metotreksat). Kutan vaskulitt. Interstitiell lungesykdom. Nyre-manifestasjon (tubulær eller glomerulær). Nevrologisk: perifer nevritt eller CNS (cyklofosfamid). Hematologis: alvorlig anemi (cyklofosfamid). Hvis cyklofosfamid (Sendoxan) anvendes, mangedobles risikoen for lymfom-utvikling.
Biologiske legemidler: Brukes (utenfor godkjent indikasjon) på enkelte indikasjoner: Glandel-manifestasjon, alvorlig (rituksimab, belimumab). Polyartritt (rituksimab eller abatacept). Kutan vaskulitt, alvorlig (rituksimab). Interstitiell lungesykdom (ILD), alvorlig (rituksimab som alternativ til cyklofosfamid). Nyre, alvorlig (rituksimab som alternativ til cyklofosfamid). Nevrologisk: perifer nevropati (rituksimab som alternativ til csDMARDs). CNS, alvorlig. Hematologisk: Hemolytisk anemi. Det er rapportert tilfeller der B-celle-hemmeren rituksimab (anti- CD20) har hatt effekt på symptomer, men en metaanalyse viste ikke virkning på spyttkjertel-funksjon, livskvalitet eller sykdomsaktivitet (Souza FB, 2016). Belimumab som brukes ved systemisk lupus kan ha effekt i utvalgte tilfeller, men erfaringene er begrenset (Alvarez-Rivera N, 2021). TNF-hemmere har ingen etablert indikasjon ved Sjøgrens sykdom.
Pilokarpin er en kolinerg agonist som stimulerer spyttsekresjon ved å binde seg til muskarin M2-reseptorer, noe som medfører kontraksjon av glatte muskelceller. Da mange pasienter har antistoffer mot muskarin M3-reseptor som kan tenkes a hemme spyttsekresjonen, kan agonister til muskarinreseptorer som pilokarpin (Salagen) 20 mg daglig og cevimelin (Evoax) tabletter forsøkes. Pilokarpin tabletter har i studier vist a kunne bedre både øye- og munnsymptomene. Ofte tar det opp til 2 måneder for bedring, og effekten sees bare så lenge pasienten anvender denne medikamentene. Bivirkninger er svette, hyppig vannlating, frysninger, hjertebank og overproduksjon av spytt. Medikamentene skal ikke benyttes ved hjertesykdom. Samlet sett ser det ut til at få pasienter har nytte av disse medikamentene, men gode studier mangler (Freige C, 2020).
Nye behandlingsprinsipper. Det er et klart behov for mer effektiv behandling av Sjøgrens syndrom. Det pågår utprøving av nye behandlingsprinsipper som omfatter behandling/modifisering av gener, bruk av stamceller og annen behandling som kan restituere vevsfunksjonen i spytt og tårekjertler. Det gjenstår å se om disse har en sikkerhet, effekt og nytteverdi som vil komme pasientene til gode (referanse: Zeng W, 2022).
Vennligst les generelt om behandling utenfor godkjent indikasjon i eget kapittel
Prognose
Sjøgrens sykdom progredierer vanligvis langsomt med økende tørrhetsplager over flere år. Sjøgren-symptomene er over tid assosiert med redusert livskvalitet (Enger TB, 2011). Resultater fra noen få studier kan tyde på klinisk bedring av kjertelfunksjonen over tid til tross for tiltakende fibrosering histologisk bedømt. Studier har ikke vist sikker økt dødelighet.
Behandlingsrespons vurderes vanligvis ut i fra anamnese, klinisk-, laboratorium- og bildediagnostikk. I studier brukes også STAR respons indeks (Seror R, 2022).
Lymfom-utvikling kommer når som helst i sykdomsforløpet. «Life time risk» er estimert til 5-10%, forutsatt at de fyller US/EU kriterier for Sjøgren-diagnosen (Alunno A, 2018; Solans-Laque R, 2011).
| Komplikasjoner i forløpet av Sjøgrens syndrom (Vivino FB, 2017) | |
| Oralt | Okulært |
| Økede karies | Keratomalaci (hornhinne-smelting) |
| Tap av tenner | Hornhinne-ulcera |
| Vekttap | Bakteriell konjunktivitt |
| Oral candida | Bakteriell interstitiell keratitt |
| Sialolithiasis | Visus reduksjon |
| Bakteriell sialoadenitt | |
| Søvn-problemer | |
| Fibromyalgi | |
Kontroller ved Sjøgrens syndrom
Pasienter med økt risiko for lymfom (se ovenfor) bør følges opp regelmessig, hver 6-12 måned, hos fastlege eller spesialist. Aktuelle undersøkelser kan omfatte: Anamnese på B-symptomer (nattesvette, feber, nedsatt appetitt, vekttap), palpasjon av glandula parotis- og submandibularis, lymfeknuter på hals og i aksiller, lever og milt, auskultasjon av lunger, vurdering av ledd, blodprøvekontroller (SR, Hb, trombocytter, leukocytter med differensialtellinger, ASAT, ALAT, CK, IgG, C3, C4). Urin stiks. Pasienter uten komplikasjoner eller aktuelle risikofaktorer og med normale prøver trenger vanligvis ikke et slikt kontroll-opplegg. Gravide bør følges i samarbeid mellom revmatolog og fødeklinikk.
Retningslinjer, anbefalinger og prosedyrer
Norsk Revmatologisk Forening / Legeforeningen
Litteratur
