ANDRE SYKDOMMER (REV 063-REV 077)
210 Osteoporose og osteomalasi / rakitt (REV 165, REV 167)
Osteoporose
Jan Tore Gran and Øyvind Palm
Kjennetegn på osteoporose og på osteomalasi
Osteoporose er asymptomatisk inntil fraktur tilkommer. Da kan sterke smerter vedvare 2-3 måneder. Oftest vertebrale kompresjonsbrudd.
Kortikosteroider øker risikoen for osteoporose, særlig hos postmenopausale kvinner.
Osteomalasi forekommer ved alvorlig malabsorption eller feilernæring og derav vitamin-D-mangel. Skjelettsmerter, ALP forhøyet, kalsium ofte lav
ICD-10: Osteoporose: M80.1 (legemiddelutløst med brudd). Osteomalasi: M83.8
Prosedyrekoder: Bentetthetsmåling SNXOXA. Infusjon av legemiddel (Aclasta): WBGM00
Definisjon
Osteoporose er en generalisert skjelettsykdom definert ved lavenergibrudd og/eller T-score ≤ -2,5 i lumbalcolumna, lårbeinshalsen eller total hofte ved måling av bentetthet/benmasse ved DXA (dual x-ray absorptiometri). Styrken i benvevet er redusert som en følge av for lite benvev av ødelagt arkitektur i det trabekulære benvevet.
Tilstanden er mest vanlig hos eldre kvinner, men kan også ramme menn og yngre personer. Osteoporose kan være forårsaket av en rekke faktorer, inkludert arv, mangel på kalsium og vitamin D, hormonelle forandringer, bruk av visse medisiner og stillesittende livsstil. Osteoporose medfører redusert livskvalitet, økt morbiditet, mortalitet og funksjonshemning (Mattew A, 2014).
I henhold til WHO definisjonen er osteoporose knyttet til hvor mange standardavvik (SD) den målte benmineraltettheten (BMD) i rygg eller hofte ligger fra middelverdien av BMD i normalbefolkningen (aldersgruppe 20-40 år). En slik tallverdi (SD) benevnes T-score. Den målte benmineraltettheten (BMD, enhet g/cm2) hos en pasient uttrykkes dermed som en relativ størrelse (T-score) når individets BMD sammenlignes med unge friske og Z-skår dersom man sammenlikner med en frisk alders-lik populasjon. Både Z- og T-score utregnes ved bruk av en formel og uttrykker hvor mange SD den målte BMD verdien ligger fra gjennomsnittsverdien til referansepopulasjonen.
Osteomalasi er en tilstand hvor nydannet ben-matriks ikke mineraliseres normalt. Deler av skjelettet blir derfor bestående av ikke-mineralisert ben (osteoid).
Normal bentetthet foreligger ved T- score > -1,0 SD
Osteopeni ved T- score mellom -1,0 og – 2,5 SD
Osteoporose ved T- score – 2,5 SD eller mindre
Etablert osteoporose foreligger ved lav benmasse kombinert med lavenergi-brudd
Epidemiologi
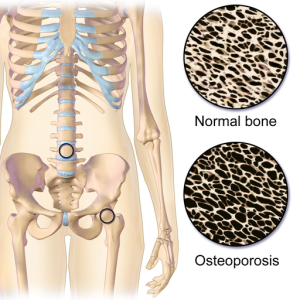
Basert på beinmassemålinger og antall frakturer er Norge i verdenstoppen med høy forekomst av osteoporose. Det er mer osteoporose og brudd i byer og tettbygde strøk enn på landsbygda (Meyer 2004). De vanligste bruddene er virvelbrudd, lårhalsbrudd og underarmsbrudd. Livstidsrisiko for lavenergi-brudd er ca. 40 % hos kvinner og 20 % hos menn (Nasjonal veileder i endokrinologi). Hoftebrudd er den mest alvorlige følgen av osteoporose. De fleste slike brudd hos eldre skyldes redusert beinmasse kombinert med et fall. I Norge rammes cirka 9000 voksne personer av hoftebrudd hvert år. Det skjer med andre ord et hoftebrudd hver time. Syv av ti hoftebrudd rammer kvinner. Risikoen for brudd øker kraftig fra 70 års alder (Folkehelseinstituttet 20.10.2016; Gregson CL, 2022).
Osteomalasi er svært sjelden, men ses ved mangel-ernæring eller sekundært til kronisk, alvorlig sykdom med vitamin D-mangel.
Genetikk
Hvite europeiske og nord-amerikanske kvinner har høyest bruddrisiko på grunn av osteoporose. Asiatiske og afro-amerikanske kvinner har lavest risiko. Hoftebrudd hos mor disponerer for osteoporose.
Patogenese
Skjelettet består av omkring 20 % trabekulært benvev og 80 % kortikalt benvev. Trabekulært benvev finnes mest i ryggvirvler, ribben og bekken, mens kortikalt benvev foreligger mest i rørknokler. Benvevet har høy metabolsk aktivitet, særlig i trabekulært vev (80%), mot 20% i kortikalt vev. Ca. 7 % av benvevet byttes årlig ut. Hos menn ses bentap gjennom hele den voksne alderen og utgjør omkring 3-5 % av den totale benmassen. Kvinnens bentap skjer hovedsakelig etter menopausen. De horisontale trabeklene blir tynnere og kan brekke til slutt (“trabecular perforation”).
Osteomalasi. Flere tilstander kan medføre osteomalasi via hypokalsemi, hypofosfatemi eller direkte hemming av mineraliseringen. Hos voksne er årsaken mangel på 25(OH)Vit D i de fleste tilfellene ved malabsorpsjon, feilernæring eller kronisk nyresvikt med tap av fosfat. Pasienter som skal unngå direkte sol og sterkt lys (systemisk lupus, noen hudsykdommer, soleksem) er også utsatt for vitamin D-mangel.
Primær osteoporose kan deles inn i postmenopausal osteoporose (tap av østrogen etter menopausen hyppigste årsak), aldersrelatert osteoporose (forårsaket av ubalanse mellom kalsium og vit D førende til sekundær hyperparathyreoidisme) og idiopatisk osteoporose.
Sekundær osteoporose skyldes flere årsaker: Glukokortikoid-indusert osteoporose (skyldes redusert osteoblast- og osteoklastaktivitet), vennligst se mer nedenfor. Endokrine sykdommer (primær hyperparathyreoidisme, endogent cushing syndrom, hypertyreose, hypogonadisme, akromegali, hypofysesvikt, hyponatriemi, diabetes mellitus). Inflammatoriske revmatiske sykdommer (RA, Bekhterevs (Ankyloserende spondylitt). Intestinal malabsorpsjon (Cøliaki, Crohns). Nyresvikt. Kronisk leversykdom og alkoholisme. Kronisk lungesykdom. Malignitet (for eks. myelomatose).
Transistent Osteoporose og Svangerskapsosteoporose. De mest kjente er transient osteoporose av hofteregion etter graviditet og Regional Migrerende Osteoporose. Hyppigst affisert er hofte, dernest kne, fot og ankel. Ingen tegn til synovitt, men diffus hevelse og lokal palpasjonsømhet er hyppig til stede. Hos gravide kvinner opptrer det hyppigst under første svangerskap – gjerne sent i annet trimester. Ofte med progredierende smerter i anterior lår og lyske. Etter 1-2 måneder kan osteoporose påvises radiologisk (DXA-måling). Ca. 20 % er bilaterale. Plagene varer fra 2-9 måneder. Residiv er sjelden. Behandles med avlastning. Svangerskapsosteoporose er vanligvis uten symptomer og skyldes fysiologisk økt kalsiumomsetning i svangerskapet og ved amming. En har beregnet at kvinner taper 4-6% av benmassen de første 6 måneder ved amming (Hopkinson JM, 2000). Det er primært det aksiale skjelettet (columna) som affiseres. Kvinner med andre risikofaktorer kan utvikle kompresjonsfrakturer (Rafey S, 2020).
Glukokortikoid- / kortikosteroid- indusert osteoporose. Kortikosteroider fører til bentap gjennom suppresjon av osteoblastene. Dermed dannes mindre ben. I tillegg økes osteoklastisk resorpsjon. Alvorlighetsgraden av steroidindusert osteoporose er avhengig av både initial og kumulativ dose og ytrer seg oftest ved brudd i virvelcorpora. Risikoen for ryggvirvel- og hoftebrudd er imidlertid vist å øke allerede ved prednisolon-doser så lave som 2,5 mg daglig. Det er mulig at benmassen kan øke spontant igjen etter avsluttet kortikosteroid-behandling.
Andre Risikofaktorer for osteoporose. Kvinne: Nesten dobbelt risiko for hoftebrudd sammenlignet med menn. Tidlig menopause. Langvarige amenoreperioder. Høy alder: En 80 år gammel kvinne har cirka 25 ganger større risiko for hoftebrudd enn en som er 55 år. Lav kroppsvekt (østrogenet dannes av androstenodione i muskler og fettvev). Lavt inntak av kalsium. Inaktivitet. Alkohol (for høyt inntak, for eksempel mer enn 3 enheter/dag). Medikamenter (tyroksin, antiepileptika, heparin, litium, statiner)
Symptomer
Osteoporose er uten symptomer inntil frakturer oppstår.
Frakturer lokaliseres oftest til de nedre thorakale eller lumbale virvelcorpora (kompresjonsfrakturer). De er ofte (ikke alltid) smertefulle initialt. Røntgen eller DXA-måling (se nedenfor) vil avdekke sammenfall, oftest i fremre del av virvelcorpora. Symptomene varer fra 4-6 uker til flere måneder. Pasientene blir smertefrie, men røntgenforandringene er varige. Som følge av thorakolumbale kompresjonsfrakturer blir ryggen ofte krum/flektert og kroppshøyden avtar. Det er uvanlig at nerverøtter og medulla påvirkes av osteoporotiske brudd.
Osteomalasi vises ved diffus smerte i ledd og skjelettet, særlig columna, bekken og under-ekstremiteter. Muskelsvakhet med gangvansker. Fraktur-tendens, mykt skjelett som kan medføre deformering av underekstremiteter (hjulbenthet), bekkenet og columna. En kan observere hypokalsemi, positiv Chovostek tegn (tetani).
Undersøkelser
Laboratorieprøver
-Beinmarkører måler dannelse av nytt benvev (P1NP) eller nedbrytning (CTX-1). Begge er vanligvis forhøyet ved høy benomsetning slik som ved osteoporose, barn i vekst, etter større frakturer, menopause, hyperparathyreoidisme, inflammasjon, redusert nyrefunksjon og Pagets sykdom. Beinmarkører kan benyttes i klinisk rutine. De er spesielt aktuelle dersom behandlingen ikke virker som forventet, eller en ønsker monitorering av antiresorptiv behandling med bisfosfonater. Det er da nyttig om beinmarkøren P1NP (se nedenfor) er målt før behandlingsstart og etter 3-6 måneder. Benmarkører egner seg ikke for screening eller diagnose av osteoporose. Vær oppmerksom på at behandling med kortikosteroider kan gi falskt lave verdier (Borgen TT, 2021).
–N-terminal Propeptide of Collagen Type I (P1NP) regnes for beste markør og måler osteoblastaktivitet (oppbygging av bensubstans). Referanseverdier: er for postmenopausal kvinne 16-96 mcg/L. Premenopausal kvinne 19-83 mcg/L. Voksen mann 22-87 mcg/L. P1NP konsentrasjonen forventes å falle 50% i løpet av 3-6 måneder etter behandlingsstart med bisfosfonater, østrogener, SERM og RANKL-hemmere og bør ligge i nedre del av referanseområdet under behandlingsperioden. Etter oppstart av anabole medikamenter forventes at P1NP etter 6 måneder er i øvre referanseområdet, det vil si >60,9 mcg/L. Riktig lengde på behandlingspause med bisfosfonater kan estimerer ved P1NP. En økning på over 30% eller til over referanseområdet indikerer økende benomsetning med ny osteoporoseutvikling som kan være indikasjon for re-start av bisfosfonat. Ved alvorlig leversykdom kan testen ikke brukes (metabolisering av P1NP gjennom lever). Også nyresvikt påvirker resultatene. Ved behandling med zoledronat (Aclasta) (se nedenfor) og andre bisfosfonater kan behandlingspauser over ett eller flere år være aktuelt. Måling av P1NP vil bidra i vurderingen om medikamentet bør kontinueres årlig eller sjeldnere. P1NP brukes også til å måle sykdomsaktivitet ved Paget sykdom.
- Beinmarkører være til hjelp i vurdering av om medikamentet virker som ønsket (resorpsjon, etterlevelse). En økning i P1NP fra utgangsnivå på >30% eller verdier > 35 mcg/L kan tilsi behov for å re-starte behandlingen.
–CTX-1 (karboksyterminalt telopeptid fra type 1-kollagen) er en markør for osteoklastaktivitet (nedbrytning av bensubstans), men er lite stabil og vanskeligere å tolke fordi den har døgnvariasjoner (prøvetakning om morgenen) og påvirkes av matinntak (fastende prøve).
-Andre blodprøver som kan tas i utredning av osteoporose: Senkningsreaksjon (SR), CRP, Hb, leukocytter, trombocytter, kalsium, albumin, kreatinin, ALAT, alkalisk fosfatase (ALP), TSH, 25-(OH)vitamin D, fosfat, parathormon (PTH) og elektroforese. Testosteron og PSA hos menn.
Osteomalasi: Forhøyet alkalisk fosfatase (nesten alle), lavt kalsium i blod og urin (>90%). Lav 25(OH) vit D (<15 ng/mL) hos nesten alle. Sekundær hyperparatyreoidisme vil medføre høy PTH.
Bildediagnostikk
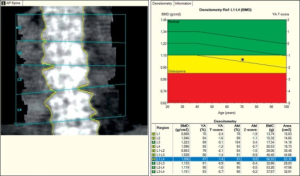
Det er funnet en sterk sammenheng mellom benmasse og skjelettstyrke. Forskjellige målemetoder som reflekterer benmassen er utviklet. DXA (“Dual Energy X-ray absorptiometry”) brukes oftest og regnes som gullstandarden. Prinsippet er at røntgenstråler med to energinivåer sendes ut. Differansen mellom utsendt stråle og målt stråle på detektor utgjør graden av absorpsjon av røntgenstråler. Den målte absorpsjon av røntgen-stråler korrelerer sterkt med mengde av det mineraliserte benvevet. Benmassemålinger brukes til å diagnostisere osteoporose og til å vurdere fremtidig frakturrisiko – da brukt sammen med andre risikofaktorer og/eller FRAX-skår (se nedenfor). Hensikten med bentetthetsmålinger er å finne fram til personer som kan ha nytte av legemidler eller andre spesifikke bruddforebyggende tiltak. En bør være oppmerksom på at falsk forhøyede verdier forekommer ved degenerative forandringer, syndesmofytter (Bekhterevs), kompresjonsfrakturer og uttalt aterosklerose.
Av andre metoder for måling av benmassen er SXA (single energy X-ray absorptiometry), ultralyd og CT. Konvensjonell røntgen anses som en dårlig metode da tegn på osteoporose først påvises når minst 30% av benmassen er tapt.
FRAX-score (brudd-risiko)
Noen benytter også FRAX-skår (på engelsk) for å estimere brudd-risiko. Kalkulator (FRAX). Vennligst følg denne lenken
Personer som tilhører følgende tre risikogrupper anbefales måling av beinmassen (Helsedirektoratet, anbefalinger 2021):
- Har brukt kortisontabletter (for eksempel prednisolon) over tre måneder eller lenger
- Postmenopausale kvinner med lavenergibrudd og minst to av følgende:
- Menopause før 45 år
- Lav vekt (BMI < 22kg/m2) eller betydelig vekttap
- Arvelig disposisjon (første grads slekt)
- Røking
- Andre disposisjoner (sykdom eller legemiddel)
- Falltendens (>1-2 ganger pr år)
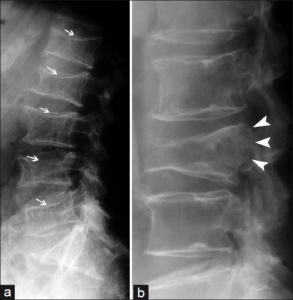
Differensialdiagnoser
- Homocystinuri
- Maligne sykdommer i skjelettet: primære tumorer og metastaser.
- Mastocytose
- Metotreksat-osteopati
- Stressfraktur-lignede non-traumatiske skader, oftest i underekstremiteter. Distale tibia angripes os >50%, calcaneus 35% og proksimale tibia 28%. Tilstanden er svært sjelden, men gjenkjennes ved typiske MR-funn med båndformede defekter som ved vekstsone-forandringer (Ruffer N, 2022).
- Multippelt myelom / myelomatose
- Osteomalasi (blant voksne): Rakitt (hos barn)
- Osteopeni
- Osteitis fibrosis cystica
- Tap av benmasse og skjelettstrukturen endres
- Forårsaket av hyperparatyreose
- I blodprøver er parathormon, oftest også kalsium og alkalisk fosfatase forhøyet
- Osteopetrose
- For høy bentetthet. Sjeldne, arvelige sykdommer
- I blodprøve er alkalisk fosfatase forhøyet
- Pagets sykdom (Osteitis deformans)
- Voksne (over 55 års alder), oftest menn.
- Skjelettsmerter
- Gradvis ombygging og fortykkelse i skjelettet, mest i bekken, lår, ryggvirvler og hodeskallen
- Alkalisk fosfatase i blod er ofte forhøyet
- Sigdcelleanemi.
Osteomalasi: osteoporose, Pagets sykdom, malignitet, hyperparathyreoidisme
Behandling
Generell forebygging. Ved osteoporose bør pasienten oppmuntres til fysisk aktivitet i form mosjon for vektbærende ledd (svømming har liten effekt). Eliminere generelle risikofaktorer som røking og alkohol, samt mer spesielle risikofaktorer (se ovenfor). Lavest mulig kortikosteroid-dose er svært viktig, helst seponering. Sørg for adekvat kosthold. Det anbefales kalsiumtillegg på 500-1000 mg/døgn som kveldsdose fordi den circadiane rytme av bentap starter etter midnatt når det ikke finnes kalsium tilgjengelig i tarm. Alle pasienter bør ha et daglig kalsiuminntak på 1000-1500 mg. I tillegg gis vitamin D (400-800 enheter pr. dag (vitamin D3).
Spesifikk osteoporosebehandling (Fra Nasjonal veileder i Endokrinologi, 2020)
Det foreligger flere medikamentelle alternativer med muligheter for persontilpassede valg.
-Yngre postmenopausale kvinner i alder 45-60 år
- Hormonbehandling
- Hvis pasienten er hysterektomert: østrogen monoterapi. Transdermal østrogen er første valg.
- Hvis bevart uterus: østrogenplaster + gestagenspiral (HT) eller østrogen/gestagen kombinasjonsplaster. Alternativt til gestagenspiral kan gestagen gis peroralt 10-12 dager hver eller hver 3. måned, i så fall anbefales kontroller med mammografi og gynekologisk us. Endelig kan østrogenplaster gis sammen med mikronisert progesteron (Utrogest på registreringsfritak).
- -Selektiv estrogen reseptor modulator (SERM), Raloxifen / Evista 60 mg x 1 peroralt daglig
- Bisfosfonater
- Zoledronat (Aclasta) 5 mg, i.v. årlig eller sjeldnere avhengig av benomsetning (se P1NP ovenfor)
- Alendronat (Fosamax) 70 mg x 1 hver uke
- Teriparatide (Forsteo) (PTH-analog) 20 µg subkutant x 1 daglig i 2 år er førstevalgspreparat ved alvorlige tilfeller med T-score ≤ -3,5, mange brudd (3 eller flere ryggbrudd på diagnosetidspunkt), svære ryggbrudd (SQ3 brudd > 40% kompresjon), eller ved nytt brudd under pågående bisfosfonat behandling
-Eldre postmenopausale kvinner i alder > 60 år
- Bisfosfonater
- Alendronat (Fosamax) 70 mg x 1 peroralt hver uke
- Zoledronat (Aclasta) 5 mg, i.v. årlig eller sjeldnere (hvert 3. år) avhengig av benomsetning (se P1NP ovenfor). Gis ved manglende effekt eller uakseptable bivirkninger av peroralt bisfosfonat.
- Denosumab (Prolia) (RANKL-hemmer) 60 mg subkutant hver 6. måned ved manglende effekt av og/eller uakseptable bivirkninger av peroralt bisfosfonat eller nyresvikt (eGFR < 30 ml/min). Kontinuerlig bruk, men nytte-risiko vurderes spesielt ved 5 år eller mer.
- Teriparatide (Forsteo) (PTH-analog) 20 µg subkutant x 1 daglig i 2 år er førstevalgspreparat ved alvorlige tilfeller med T-score < -4,0, mange brudd (3 eller flere ryggbrudd på diagnosetidspunkt), svære ryggbrudd (SQ3 brudd > 40% kompresjon), eller ved nytt brudd under pågående bisfosfonat-behandling.
- Romosozumab (Evenity) injeksjoner månedlig i ett år til postmenopausale kvinner med alvorlig osteoporose. Aktuelt ved ved alvorlige tilfeller med T-score < -4,0, mange brudd (3 eller flere ryggbrudd på diagnosetidspunkt), svære ryggbrudd (SQ3 brudd > 40% kompresjon), eller ved nytt brudd under pågående bisfosfonat-behandling.
-Menn
- Bisfosfonater
- Alendronat (Fosamax) 70 mg x 1 peroralt hver uke
- Zoledronat (Aclasta) 5 mg, i.v. årlig eller sjeldnere avhengig av benomsetning (se P1NP ovenfor). Gis ved manglende effekt eller uakseptable bivirkninger av peroral bisfosfonat
- Denosumab (Prolia) 60 mg subkutant hver 6. måned ved manglende effekt av og/eller uakseptable bivirkninger av peroral bisfosfonat eller nyresvikt (eGFR < 30 ml/min)
- Teriparatide (Forsteo) (PTH-analog) 20 µg subkutant x 1 daglig i 2 år er førstevalgspreparat ved alvorlige tilfeller med T-score ≤ -3,5, mange brudd (3 eller flere ryggbrudd på diagnosetidspunkt), svære ryggbrudd (SQ3 brudd > 40% kompresjon), eller ved nytt brudd under pågående bisfosfonat-behandling
- Testosteron-tilskudd i form av enten Nebido 1000 mg i.m. injeksjon hver 3. måned eller testosteron gel percutant daglig hvis hypogonadisme.
Pasienter < 45 år: Individualisert behandling, krever spesiell kompetanse.
Steroidutløst osteoporose / profylakse ved steroid-behandling (Fra Nasjonal veileder i Endokrinologi, 2020)
Ved planlagt bruk av glukokortikoider i doser tilsvarende ≥ 5 mg prednisolon i > 3 måneder og tidligere lavenergi-brudd eller T-score < -1,0, bør man starte med alendronat (ev. annen behandling ved intoleranse). Ved T-score ≤ -3,5 eller hvis brudd under annen behandling, kan man vurdere Teriparatide. Det må søkes HELFO om individuell refusjon for pasienter som ikke oppfyller de vanlige blå-reseptkravene for osteoporose. Kalsium og vitamin D gis til alle.
Ved osteomalasi behandles utløsende årsak, korrigere elektrolytt-forstyrrelser (hypfosfatemi, hypokalsemi) og supplere med D-vitamin.
Prognose og oppfølging ved osteoporose
(Fra Nasjonal veileder i Endokrinologi, 2020)
Kontrollen omfatter primært evaluering av ev. bivirkninger og smerteproblematikk, høydetap, kontroll av kalsium-metabolismen og kontroll av behandlingseffekter. Ved osteoporose gjøres kontroll av DXA etter 2 år: Det forventes stigning i BMD på 5-10 % i columna, 2-6 % i hoften etter tre års behandling med bisfosfonater eller Denosumab. Størst effekt sees det første året.
Etter 5 års behandling med bisfosfonater kan man ikke forventer ytterligere økning av BMD. Denosumab gir kontinuerlig økning av BMD over en periode på 10 år. Det forventes mer moderat stigning ved HT og SERM enn ved behandling med bisfosfonater og Denosumab. Hb, leukocytter, eGFR, 25-OH vitamin D, fritt kalsium etter 6 måneder og deretter årlig. Man forventer en 50 % reduksjon i beinmarkører (P1NP) under behandling. P1NP under antiresorptiv behandling bør ligge i nedre tredjedel av referanseintervallet (P1NP <35mcg/L).
Ved Anabol behandling med PTH-analog (teriparatide)
Ved behandling med PTH forventer man økning på minst 50 % av beinmarkører, men det sees stor inter-individuell variasjon, og økningen avtar noe etter en tid. 6 måneder: Beinmarkører (P1NP), fritt kalsium. PINP er den foretrukne beinmarkør og økning ved 6 mnd. predikerer BMD økning etter 2 år. 12 måneder: DXA, beinmarkører (P1NP), fritt kalsium. 24 måneder: DXA, beinmarkører (P1NP), fritt kalsium
Behandlingssvikt
Definisjon ved osteoporose: Signifikant fallende BMD (> 3 % i rygg målt i g/cm2) eller > 1 lavenergifraktur etter minst 1 års behandling. Dårlig etterlevelse må overveies og beinmarkører (P1NP) bør kontrolleres, se over. Mer potent antiresorptiv terapi eller anabol terapi må vurderes. Hos pasienter > 75 år, som ikke antas å kunne administrere anabol behandling med teriparatide er bytte fra bisfosfonat til Denosumab et godt alternativ. Endring i BMD bør sammenlignes i g/cm2 og ikke i T-score.
Behandlingsvarighet
Bisfosfonater. Behandlingspause kan overveies etter 5 års behandling med alendronat eller 3 års med zoledronat, hvis BMD-målinger etter behandling ligger høyere enn -2,5, og det ikke er oppstått nye frakturer under behandlingen. Hvis fortsatt T-score ≤ -2,5 anbefales behandling opptil 10 år eller bytte til Denosumab. Årsaken er at risikoen for patologiske brudd øker med behandlingslengden (se tabellen nedenfor).
| Patologiske brudd under behandling med bisfosfonater (Pearce O, 2021) | |
| Behandlingsvarighet (år) | Prevalens / 100.000 person-år |
| 2 | 1,78 |
| 6-8 | 38,9 |
| >10 | 107,5 |
Teriparatid (PTH-analog). Skal aldri brukes mer enn 2 år med indikasjon osteoporose. Skal etterfølges av annen behandling.
Denosumab (RANKL-hemmer). Langtidsbruk er vist å være trygt og gir kontinuerlig økning av BMD. Effekten forsvinner raskt etter seponering med stor risiko for nye brudd, spesielt multiple vertebrale brudd. Dersom behov for å slutte med Denosumab bør spesialavdeling konfereres.
Hormonbehandling. Ev. overgang til annen behandling kan overveies ved 60 års alder, eller etter 10 år, hvis tidlig oppstart, men nye studier viser persisterende positive effekter på helse og mortalitet i opptil 18 år.
Oppfølging etter seponering eller ved behandlingspauser
(Fra Nasjonal veileder i Endokrinologi, 2020)
Årlig kontroll av beinmarkører, og DXA hvert 2.-3. år etter seponering kan være aktuell. Indikasjoner for revurdering av behandling er stigning av beinmarkører på 30 % eller klinisk relevant fall i BMD. Ved forventet levetid < 5 år og adekvat gjennomført bisfosfonat-behandling i 3-5 år, kan oppfølgingen avsluttes.
| Tabell: Osteoporose-medikamenter. (fra Nasjonal Veileder i Endokrinologi, 2020) | |||
| Legemiddel-
gruppe |
Virknings-mekanisme | Viktigste kontraindikasjoner* | Bivirkninger/ kommentarer. |
| Østrogen/
(gestagen) |
Antiresorptiv,
Påvist effekt på vertebrale og nonvertebrale brudd. |
Mamma cancer (også tidligere), endometriecancer. Økt risiko for DVT og lungeemboli (for eks. Leiden mutasjon pos.) | Det er påvist en liten økt risiko for brystkreft i amerikanske, men ikke i europeiske randomiserte, prospektive studier ved bruk av kombinert østrogen/gestagen behandling. Østrogen monoterapi ikke assosiert med økning av risiko for brystkreft. Hos kvinner som starter hormonbehandling før 60-års alder er risiko for kardiovaskulær sykdom nedsatt, mens kvinner som starter etter 60 års alder synes å ha økt risiko. Økning av risiko for tromboemboli ved bruk av perorale preparater, men ikke påvist ved bruk av transdermal administrasjon. |
| Selektive estogen receptor modualor (SERM) Raloxifen / Evista | Antiresorptiv,
Kun vist effekt på vertebrale brudd |
Økt risiko for DVT og lungeemboli | Lett økt risiko for slag. Reduserer risiko for brystkreft |
| Perorale og intravenøse bisfosfonater | Antiresorptiv,
vist effekt på hoftebrudd og vertebrale brudd |
eGFR < 35 ml/min., hypokalsemi, 25-OH vitamin D < 25 nmol/L). I tillegg gjelder for peroral: Alvorlige refluks plager, øsofagusstenose, akalasi. Manglende evne til å være oppreist 30 minutter etter inntak. | Kjeve-osteonekrose (ONJ), særlig ved iv administrasjon og samtidig malignitet. Atypiske femurfrakturer (særlig ved langtidsbehandling). Risikoen (1/10.000-1/100.000) påvirker ikke risk/benefit ratio for disse legemidler i betydelig grad. |
| RANKL-hemmer (denosumab) | Antiresorptiv | Hypokalsemi, 25-OH vitamin D < 25 nmol/L). | Som bisfosfonater. Effekten av medikamentet opphører raskt etter seponering med høy risiko for nye frakturer. |
| PTH-analog (teriparatide) | Anabol, forebyggende effekt på frakturer i columna | Hyperkalsemi, Mb. Paget, Uavklart høy ALP, eGFR < 30 ml/min., tidligere malignitet/stråling mot skjelett. | Smerter i ekstremitetene muskelkramper, kvalme tachykardi, nyresvikt, hyperkalsemi. Ingen øket risiko for osteosarkom |
Retningslinjer
Storbritannia, Gregson CL, 2022
Europeiske guidelines, postmenopausal osteoporose, Kanis JE, 2019
Nasjonal veileder i Endokrinologi
Litteratur
Nasjonal veileder i Endokrinologi, 2020
Rosen CJ, 2020 (epidemiologi og patogenese)
Munns CF, 2016 (Osteomalasi, rakitt)
