ANDRE SYKDOMMER (REV 063-REV 077)
205 Myopati ved lipidsenkende medikamenter. Statinmyopati (REV 022, REV 073, REV 082)
Øyvind Palm
Kjennetegn på statin-myopati
Muskelsmerter etter oppstart med statin-behandling.
Ved toksisk statin-myopati og rabdomyolyse kan store muskel- og nyreskader oppstå.
Autoimmun statin-myopati / Immunmediert nekrotiserende myopati (IMNM) kjennetegnes av vedvarende myositt-symptomer, høy CK og HMGCR antistoff i blodet.
ICD-10; G72.0 (legemiddelutløst). G72.2 (toksisk)
Definisjon
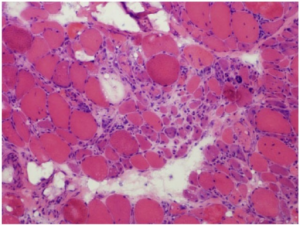
Statiner (HMG-CoA reduktase-hemmere) er kolesterolsenkende medikamenter som brukes mot hyperlipidemi. Virkningsmekanismen er hemming av HMGCR enzymet som er et nøkkelenzym i syntesen av kolesterol (Selva-O’Callaghan A, 2018). Det er godt dokumentert at statiner senker LDL-kolesterol og dermed risiko for hjerteinfarkt, slag og andre hjerte- og karsykdommer. Bivirkninger er imidlertid ikke uvanlig, hvorav muskel-bivirkninger er blant de vanligste. Disse kan deles i tre hovedgrupper: 1) Myalgi er vanligst og forløper da uten forhøyet kreatin kinase (CK) eller andre tegn til skade på muskelceller og med normale antistoff (ANA, HMGCR). Symptomene forventes å gå raskt tilbake når behandlingen stanses. 2) Toksisk myopati som kan utvikle seg til rabdomyolyse. En ser muskelskade og ved rabdomyolyse også skyhøy kreatin kinase (CK) i blodet (Stroes ES, 2015), men ikke en autoimmun sykdom med antistoffutvikling. Væskebehandling og observasjon med tanke på nyreskade er aktuelt. 3) Immunmediert nekrotiserende myopati (IMNM) med HMGCR antistoff. Andre typer IMNR er anti- SRP positiv type og antistoff-negativ type. Disse kjennetegnes alle av aggressiv, rask sykdomsutvikling med muskelsvakhet og høy CK i blodet (Hamann P, 2013). Vennligst les mer om nekrotiserende myopatier i kapitlet om myositt.
Forekomst
Toksisk statin myopati. Totalt avslutter 5-20% av pasienter som bruker statiner behandlingen på grunn av muskelsymptomer (Mohassel p, 2013). De færreste har tegn på muskelcelleskader. Studier på myalgi utløst av statiner har overraskende nok vist nesten like mye muskelplager blant dem som fikk placebo, slik at sammenhengen er omdiskutert (Ganga HV, 2014). De aller fleste har normal kreatin kinase (CK) i blodet. Det mangler en god forklaring på diskrepansen fra klinisk praksis der mange rapporterer myalgi, men myalgi er observert vanligere ved høyere doser statiner og simvastatin og lovastatin har høyere risiko enn fluvastatin og pravastatin. Toksisk statin-myositt og rabdomyolyse er mye sjeldnere. Dersom en CK-stigning på 10 ganger over referanseområdet legges til grunn, forekommer toksisk statin-myopati trolig hos færre enn 1/10.000 statin brukere og rhabdomyolyse med CK 10-20.000 er antatt å være sjeldnere enn 1/100.000 (Dalakas MC, 2009; Armitage J, 2007). Hard fysisk trening øker risikoen for statin-indusert muskelskade (Chhetry M, 2023).
Statin-assosiert autoimmun myopati / immunmediert myopati. Denne bivirkningen er svært sjelden med innsidens på 2-3/100.000/år (Mammen AL, 2016). Blant pasienter med myositt antas denne formen å utgjøre 6% (i et selektert amerikansk materiale) (Watad A, 2015). Anti-HMGCR (3-hydorxy-3-methylglutaryl-coenzym A reduktase) kan påvises (må rekvireres spesifikt) hos de fleste, og kan bidra til å skille fra toksisk statin-myopati. Anti-HMGCR antistoff i blodet er imidlertid ikke helt spesifikt eller sensitivt. Det ses hos ca. 50% med nekrotiserende immunmediert myopati (IMNM) uten forutgående statin-bruk, og noen med statin-assosiert autoimmun myopati / immunmediert myopati mangler antistoffet (Aggarwal R, 2020).
Symptomer
Statin-myalgi uten muskelcelleskade (normal CK) medfører smerter, og stivhet i muskler. Noen rapporterer muskelkramper. Symptomene går tilbake i løpet av noen dager etter seponering av statiner. Statin-myalgi ses ofte kort tid etter påbegynt statin-behandling.
Toksisk statin myopati og rabdomyolyse medfører muskelsmerter (myalgi), men også muskelsvakhet. Noen hovner kraftig opp med ødemer over angrepet muskulatur eller capillary leak syndrom i mer ekstreme tilfeller. Symptomene kan oppstå under statinbehandling når andre faktorer tilkommer, slik som etter hard fysisk trening eller supplerende medikasjon som nedsetter statin-metabolismer og øker serumkonsentrasjonen via P450 3A4 (CYP3A4) isoenzym (paravchol (pravastatin), fluvastatin (Lescol) benytter andre enzymsystemer). Også ciclosporin (Sandimmun Neoral) og kolkisin som brukes mot andre revmatiske sykdommer, makrolid-antibiotika, noen antimykotika, HIV/HCV protease hemmere, gemfibrozil, diltiazem, verapamil, amiodarone disponerer. Sjekk interaksjoner via interaksjoner.no
Statin-assosiert autoimmun myopati kan ligne klassisk myositt, men muskelsmerter trenger ikke være så uttalt. Muskelsvakhet, mest i proksimale muskelgrupper (lår, overarmer), og dysfagi er derimot mer utpreget. Svakheten utvikler seg ofte påfallende raskt, ofte med tydelige symptomer få uker etter symptomdebut. denne myopatien kan oppstå etter flere års statin-bruk. Genetiske faktorer (SLCO1B1) gener og alder over 50 år, samt komorbiditet som lever- eller nyresykdom og ukontrollert diabetes mellitus antas å disponere (Szczesny P, 2008; Jayatilaka S, 2021). Ekstramuskulære manifestasjoner er mindre vanlig enn ved andre myositt-tilstander.
Medisinske Undersøkelser
Anamnesen omfatter bruk av statiner og disposisjon for muskelsykdommer (myositt, non-inflammatorisk myopati), tidligere symptomer (myalgi), bruk av andre medikamenter og forutgående uvanlig belastning.
Klinisk undersøkelse: Ved toksisk myopati og ved rabdomyolyse ses muskelsvakhet, særlig i proksimale muskelgrupper. Pasienten kan ha problemer med å reise seg fra stolen eller fra huksittende, noen sliter med å strekke nakken. eller har også svelgevansker (på grunn av redusert øsofagusmotilitet). Ved autoimmun myopati/myositt (IMNM) forventes mer gradvis utvikling av svakhet til proksimale muskler og symmetrisk muskelatrofi. Tegn til artritt, eksantem og lungemanifestasjoner vurderes, men er sjelden. Vennligst se også eget kapittel om utredning.
Laboratorieprøver: CRP, SR, Hb, leukocytter med differensialtelling, trombocytter, lever- nyre- og thyreoidea-funksjonsprøver, elektrolytter med kalium og kalsium og kreatin kinase (CK), supplert med antinukleære antistoff (ANA). Urin-stiks. Ved muskelcelleskade forventes kreatin kinase (CK), ASAT og LD å være forhøyet. CK stiger ved fysisk trening. Forhøyede CK -nivåer forventes å halveres ca. hver 24-36 timer dersom utløsende årsak er fjernet. Normalisering i løpet av 3-5 dager forventes, slik at noen dagers treningspause før prøvetakning anbefales. Toksisk myopati er ikke assosiert med spesielle antistoff, slik at ANA og subgrupper, inklusiv myositt spesifikke antistoff forventes å være normale. Ved mistanke om statinutløst autoimmun myositt er måling av antistoff mot HMGCR essensielt. Analysen utføres ved Immunologisk laboratorium, Oslo Universitetssykehus, men inngår (pr 2021) ikke i rutine når en rekvirerer ANA-test eller myositt-spesifikke antistoff. Ved toksisk myopati og rhabdomyolyse er CK forhøyet, ved rabdomyolyse på 10.000-20.000 eller høyere) (De Schryver, 2015).
Bildediagnostikk. Dersom en mistenker toksisk myopati, rabdomyolyse eller autoimmun myopati eller kan MR av muskler (oftest lårmuskler) være nyttig. En forventer å finne patologisk ødem i muskler og noe i tilstøtende muskelfascier. Ved langvarig forløp ses muskelatrofi og fett i musklene. Lokaliseringen av inflammasjons-tegn på MR kan vise egnet sted for muskelbiopsi som da ofte er neste steg i utredningen. CT av lunger vurderes dersom mistanke om lungemanifestasjon.
EMG: En forventer ikke spesifikke funn ved toksisk myopati. Ved autoimmun muskelsykdom ses er myopatisk mønster uten ikke tegn til nevrogen muskelsykdom.
Biopsi er vesentlig dersom det foreligger kliniske tegn til muskelcelleskader. Milde tilfeller: Cytokrom oksidase negative fibre og vakuoler. Alvorlig affeksjon: Muskelfiber nekroser og regenerasjon med antydet inflammasjon. Ved statin-assosiert autoimmun myopati ses muskelfiber-nekroser, relativt lite lymfocyttinfiltrasjon, men tegn til regenerasjon med lite inflammasjon, MHC klasse I er oppregulert og Membran Attack Complex (MAC) på ikke-nekrotiske fibre.
Diagnose
Diagnosen baseres på symptomer, anamnese, klinisk undersøkelse, laboratorieprøver, bildediagnostikk og biopsi (se ovenfor). Også forløpet er av betydning fordi myalgi ved statin-bruk forventes å debutere innen 4 uker fra oppstart, og går vanligvis tilbake i løpet av noen dager-uker fra seponering av statin. Oftest er pasientene symptomfrie etter 2-3 måneder, men opp til 14 måneder med symptomer er også beskrevet. Ved toksisk myopati eller rabdomyolyse øker symptomene på over flere dager før de langsomt normaliseres etter statin-seponering. Autoimmun statin-myopati kan ha symptomer som går langsommere tilbake, vedvarer eller progredierer til en vedvarende sykdom, selv etter statin-seponering.
Differensialdiagnoser
- Andre former for myositt
- Inklusjonslege myositt
- Muskeldystrofi
Behandling
Før en velger behandlingsstrategi er det nyttig å vurdere indikasjonen for statin-bruk og ekskludere risikofaktorer, andre relaterte sykdommer og former for myopati. En ser også på alvorlighetsgraden av myopati ut i fra nivået på CK i blodet. Dersom CK er under 1000 IU/L (eller < 5 ganger øvre referanseområde) og pasienten er uten muskelsvakhet ved klinisk undersøkelse, kan en ofte kontinuere statin-behandlingen. Det forutsetter oppfølging, at CK ikke stiger og at nye symptomer er fraværende. Hvis CK øker til mer enn 10 ganger øvre referanseområde bør klinikeren vurdere å seponere statin-behandlingen. Generelt anbefales at pasienter med høy risiko for kardiovaskulære hendelser (tidligere hjerteinfarkt og tilsvarende) med myalgi, men uten CK-stigning eller muskelsvakhet kontinuerer med statin (Selva-O’Callaghan A, 2018).
Behandlingsmål kan være symptomfrihet, normal eller nærmest normalt CK-nivå i blodprøvene og gradvis normalisering av muskelstyrke. Sykdommen forløper individuelt forskjellig og valg av behandling og behandlingsintensitet vurderes i den sammenheng.
Dersom pasienten er fysisk svært aktiv, bør treningsmengden reduseres og hard muskelbelastning unngås. Toksisk statin myopati forventes å gli over uten andre spesielle tiltak enn statin-seponering. Dersom ikke tydelig bedring av symptomer, CK -verdier og muskelkraft etter 3 måneder gjøres videre utredning (klinisk re-vurdering, CK, antistoff, MR lårmuskler, biopsi).
Ved statin-assosiert autoimmun myopati vurderes indikasjon for immundempende behandling slik som ved poly-/dermatomyositt er aktuelt med kortikosteroider (Prednisolon, Solu-Medrol) i kombinasjon med DMARDs som metotreksat, alternativt azathioprin (Imurel) eller mykofenolat (CellCept/Myfortic). Intravenøs immunglobulinbehandling (IVIG) kan også vurderes. Rituksimab er et alternativ (mest i aggressive sykdomsforløp). I noen tilfeller legges rituksimab til den øvrige medikasjonen (Allenbach Y, 2018). Behandlingsvalg gjøres etter grundig vurdering der både antistoff-profil og biopsisvar kan være av betydning. En forsøker ofte å avslutte den immunsuppressive behandlingen etter to år, men tilbakefall er da ikke uvanlig.
Ved behov for fortsatt reduksjon av kolesterol kan lavere statin-dose, et annet statin eller bytte til annen kolesterolsenkende behandling som ezetimib/Ezetrol eller PCSK-9 hemmere/Pralvent/Repatha vurderes. Supplerende er intensivert livsstilsendring og kosthold.
Retningslinjer, anbefalinger og prosedyrer
Lundberg IE, 2017: EULAR Klassifikasjon av myositt
Allenbach Y, 2018; ENMC anbefalinger
Revmatologisk forening/Legeforeningen 2020
Selva-O’Callaghan A, 2018 (eksperts opinion)
Litteratur
Ljøstad U, 2016: Autoimmun myopati ved statinbruk Tidskr Legefor
Tonstad S, 2017, Legeforeningen
Podcast “Revmatologi/immunmediert nekrotiserende myopati” med Jens Vikse
