VASKULITT (REV 034-052)
97 Mikroskopisk polyangiitt (MPA) (REV 034)
Ragnar Gunnarsson
Kjennetegn på MPA
Affeksjon av lunger forekommer ofte, noen ganger uten særlige symptomer (Husk: CT thorax).
Nyreaffeksjon med pauci immune glomerulonefritt som ubehandlet medfører redusert nyrefunksjon og nyresvikt (Husk: urin-undersøkelse som da visermikroskopisk hematuri og/eller nefritisk urin sediment).
Nerveaffeksjon oftest med mononeuritis multiplex, samt hudvaskulitt forekommer.
Almenn symptomer som feber, vekttap, utmattelse og leddsmerter er vanlige.
Høye inflammasjonsparametere (SR og CRP) samt påvist anti-MPO-ANCA IgG i blodprøve hos de aller fleste med aktiv sykdom.
Fleste av pasientene er eldre en 50 år. Sykdommen kan enten utvikle seg gradvis over tid eller ha stormende forløp.
Diagnosekoder ICD-10: Tiende versjon av den internasjonale statistiske klassifikasjonen av sykdommer og beslektede helseproblemer i regi av WHO (ICD10).
M31.7 Mikroskopisk polyangiitt (MPA). N08.5* Glomerulonefritt. N17.8 Annen spesifisert akutt nyresvikt. J99.1 * Åndedrettsforstyrrelser ved andre diffuse bindevevssykdommer. J84.0 Diffuse alveolar blødning. G58.7 Mononeuritis multiplex
Prosedyrekoder: 6-minutter gangtest: FYFX05. Intravenøs infusjon: WBGM00. Infusjon med gammaglobulin: RPGM05. Intravenøs infusjon med cytostatika: WBOC05. EKG: FPFE15
ATC koder (for legemiddelstatistikk): Prednisolon: H02A B06 Immunsuppressive legemidler: L04A A. Behandling med rituksimab: L01XC02. Behandling med cyklofosfamid: L01AA01.
Historikk
Mikroskopisk polyangiit ble første beskrevet av Friedrich Wohlwill i 1923 som «mikroskopisk form» av polyarteritis nodosa.
Definisjon
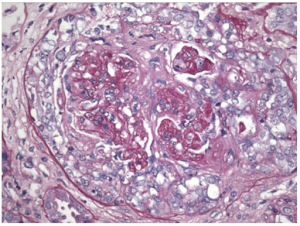
Mikroskopisk polyangiitt (MPA) er definert som en nekrotiserende vaskulitt i små kar (dvs. kapillærer, vener eller arterioler) uten eller med få immunavleiringer. Nekrotiserende glomerulonefritt (GN) er vanlig og samt og lunge-kapillaritt. MPA gir som oftest, ikke affeksjon av øvre luftveier og bihuler (som GPA). Anti-neutrofile cytoplasmatiske antistoffer er vanligvis rettet mot myeloperoksidase (MPO) som gir et perinukleært mønster (P-ANCA) ved indirekte immunfluorescens på etanol-fikserte snitt. MPA kan skilles histologisk fra granulomatose med polyangiitt (GPA) med fravær av granulomatøs betennelse og granulomer.
Genetikk og patogenese
Mikroskopisk polyangiit (MPA), granulomatose med polyangiit (GPA) og eosinofil granulomatøs polyangiit (EGPA) er klassifiserte som ANCA assosierte vaskulitter (AAV). Årsaken for å den enkelte pasienten utvikler MPA er ukjent. MPA og GPA har forskjellig genetisk assosiasjon som tyder på at dette er separate sykdommer som deler flere felles kliniske og patologiske trekk. GWA-studier («Genome-Wide Association Studies») bekreftet forskjell mellom GPA og MPA som ikke er assosiert til den kliniske fenotypen, men assosiert til antistoff tilknytningen, dvs. om de er anti-PR3-ANCA eller -MPO-ANCA positive. HLA-DQ er assosiert til MPA hos europeiske pasienter, men hos japanske MPA-pasienter kan sees assosiasjon til DRB1 ∗09:01. PTPN22 genet koder for lymfoide thyrosinfosfatase (Lyp) og har avvik der viser sammenheng mellom utvikling av både GPA og MPA. Sannsynlig via abnormal CD4 T-celle (Treg) aktivitet som leder til økt humoral aktivitet og forandret nøytrofil funksjon. På den andre siden er HLA-DPB1*0401, PRTN3 (Proteinase 3 Neutrophil Serine Protease), SERPINA1 (Alfa1 antitrypsin: serin protease inhibitor) er assosiert til PR3-ANCA (1-4).
Det finnes dyremodell ved anti-myeloperoksidase ANCA (MPO-ANCA) vaskulitt, der anti-MPO-ANCA kan indusere vaskulitt i forsøksdyr i relativt enkle dyremodeller.
Granulom-dannelse er et av de histologiske trekkene ved GPA og EGPA, men sees ikke ved MPA.
Epidemiologi
Det er en geografisk variasjon i AAV med høyere forekomst av GPA i Nord-Europa og Australia, og en høyere frekvens av MPA i Sør-Europa og i Asia. MPA kan påvirke pasienter i all alder; imidlertid er de fleste av pasientene vanligvis eldre en 50 år. En nylig studie fra Olmsted fylke i delstaten Minnesota viste en alders- og kjønnsjustert årlig forekomst av MPO-AAV hos voksne var 2,0 (95% CI: 1,3-2,6) per 100 000 innbyggere, mens prevalens av MPA var 18,4 (95% CI: 10,1–26,7) per 100 000 (5).
Klassifikasjon og estimering av sykdomsaktivitet og skade
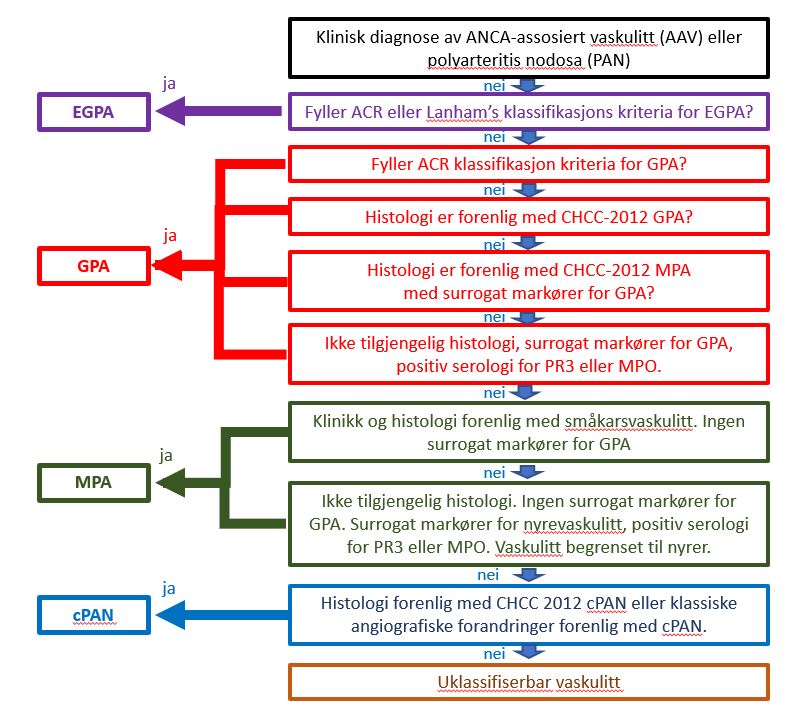
I 2012 på den internasjonal vaskulitt-konsensuskonferansen som ble avholdt i Chapel Hill i delstaten North Caroline («Chapel Hill Consensus Conference» CHCC 2012) og MPA var definert som del av ANCA assosierte småkars-vaskulitter (AVV) (6). Før publisering av 2022 ACR/EULAR klassifikasjonskriteria for ANCA vaskulitter med særskilte klassifikasjonskriteria for GPA, EGPA of MPA (35-37) har det ikke vært internasjonalt anarkjente klassifikasjonskriteria for MPA (Figur 1) (37). Før dette har var klassifikasjonen av bl.a. MPA basert seg på eksklusjon med ed hjelp av flytskjema algoritme anbefalt bl.a. av European Medicines Agency (EMA) (Figur 2) (7)
Sykdomsaktivitet ved MPA som ved GPA og EGPA vurderes etter Birmingham Vasculitis Activity Score versjon 3. Der er maksimal score på 63 poeng. Ved vedvarende sykdom er det maks. score på 33 poeng. Komplett remisjon angis som BVAS =0 med per oral Prednisolon 7,5 mg eller lavere mens vedvarende «sustained» remisjon som BVAS = 0 i 6 måneder eller mer. Kalkulator for BVAS v3 for Iphone og Android telefoner og på PDF-fil. (8, 9).
Skadeaktivitet vurderes etter Vasculitis Damage Index (VDI) (10). Skåring i VDI er permanent og poeng beholdes, men skaden må ha stått i minimum 3 måneder. VDI kalkulator: Vasculitis Damage Index (VDI).
Figur 1. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for microscopic polyangiitis. (37).
Figur 2. European Medicines Agency (EMA) algoritme ved klassifikasjon av ANCA-assosiert vaskulitt og polyarteritis nodosa (7).
ACR: American College of Rheumatology; CHCC-2012 : Chapel Hill Consensus Conference 2012; cPAN : classic polyarteritis nodosa; EGPA : eosinofil granulomatose med polyangiitt; GPA : granulomatose med polyangiitt; MPA : mikroskopisk polyangiitt. MPO : myeloperoksiadase; PR3 : proteinase 3.
Kliniske manifestasjoner
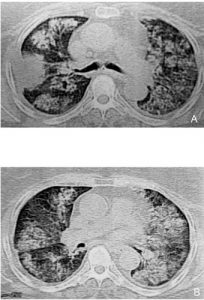
Allmenntilstand, nyrer. MPA kan ha et bredt spekter av kliniske presentasjoner fra sykdom begrenset til nyreaffeksjon til kritisk lunge og nyreaffeksjon i form av pulmo-renal syndrom. I de fleste tilfeller begynner imidlertid sykdommen med snikende uspesifikke symptomer, vanligvis prodromologiske konstitusjonelle symptomer som; lav gradig feber, artralgi, vekttap og ubehag som i løpet av få uker eller måneder. Akutt presentasjon manifesterer seg hovedsakelig med alveolære lungeblødninger («diffuse alveolar hemorrhage», DAH) og/eller med raskt progressiv glomerulonefritt (RPGN) eller nerveaffeksjon i form av mononevritis multipleks.
Interstitiell lungesykdom med lungefibrose, i tillegg er annen lungeaffeksjoner som bronkiektasi men foreløpig er hyppighet og alvorlighet av dette lite kartlagt i epidemiologiske studier.
Kutane manifestasjoner (10–60%). Hudbiopsier ved MPA er ikke diagnostiske og viser som regel leukocytoklastisk vaskulitt, med fibrinoid nekrose, nøytrofil infiltrasjon av dermale kar. Hyppigste hudlesjonen er palpabel purpura, deretter hudsår, livedo reticularis, og vaskulittisk urticaria.
Affeksjon av gastrointestinal systemet ser ut til å være heldigvis sjelden (2-10%) men er assosiert til alvorlige komplikasjoner i form perforasjon og død.
Nerveaffeksjon er beskrevet hos 20-40% av MPA pasienter. Vanligste affeksjonen er perifer nevropati. Det kan gi både distal symmetrisk nevropati og som oftest, men ikke alltid gir smertefull nevropati. I tillegg kan MPA gi klassisk mononevritis multipleks. Det er uvanlig å få affeksjon av sentralnervesystemet ved MPA. Affeksjon av kraniale nerver er uvanlig og betydelig sjeldnere enn ved GPA.
Okulære manifestasjoner er sjeldnere ved MPA en GPA. De hyppigste okulære manifestasjonene er episkleritt, skleritt, iridocyklitt og konjunktivitt. Affeksjon av retina er svært sjelden med vaskulitt involvering kar i choroid-membranen, netthinne og konjunktiva.
ØNH manifestasjoner er betydelig sjeldnere ved MPA sammenlignet med GPA og EGPA, men de kan forekomme. Dette kan påvirke de øvre luftveiene og indre øre med hørselstap.
Hjerteaffeksjon er beskrevet hos 3–18%. Den kan ha forskjellige kliniske former. De vanligste rapporterte hjerte manifestasjonene er perikard effusjon og kronisk hjertesvikt. MPA kan gi vaskulitt av koronare kar med utvikling av hjerteinfarkt, perikarditt, myokarditt og endokarditt.
Laboratoriefunn
Høy senkningsreaksjon (SR) og forhøyet C-reaktiv protein (CPR) med normocytær normokrom anemi og trombocytose som gjenspeiler hos aller fleste generalisert inflammasjonsaktivitet. Differensial telling av leukocytter er viktig med tanke på eosinofili og evt. andre differensialdiagnoser. Procalcitonin er vanligvis normal ved AAV men kan være moderat forhøyet.
Nyrefunksjon. Det er svært viktig å ta nyrefunksjonsparametere og forsikre seg urinprøve for urinstiks og mikroskopi.
ANCA screening med testing for PR3- og MPO- ANCA og på Oslo Universitetssykehus går det an å få ANCA test i løpet av få timer hvis kliniske situasjonen krever det og da evt. også anti-GBM hvis kliniske bildet kan være forenlig med Goodpastures syndrom som er en immunologisk betinget sykdom som skyldes auto-antistoff mot basalmembranen i lunge og nyrevev.
Diagnose
Diagnosen av MPA stilles på mønstergjenkjenning. Der det kliniske sykdomsbilde støttes opp av kliniske funn og samt blodprøve inklusiv ANCA og eventuelt urin og aktuelle radiologisk funn (CT lunger/luftveier, CT/MRI bihuler og tinningben). Det foretrekkes at diagnosen blir histologisk verifisert med biopsi fra som oftest nyre, alternativt fra lunge/luftveier. Histologisk påvises vaskulitt og/eller pauci-immun glomerulonefritt. Kapillaritt med fibrinoid nekrose er det typiske funn i lungene med, i motsetning til de andre to ANCA assoisierte vaskulittene; GPA og EGPA, er ved MPA fravær av granulomatøs betennelse og granulomer.
Differensial diagnoser ved MPA
Annen ANCA vaskulitt som EGPA eller GPA. I tillegg Goodpastures/anti-GBM syndrom.
Vaskulitt-lignende sykdommer inkluderer en rekke tilstander deriblant medikament utløste tilstander, for eksempel. propyltiouracil (11) utløst tilstand. Ulovlige midler inkludert kokain og levamisol som er ofte brukt som tilsetningsstoff til kokain kan gi AAV liknende tilstand.
Infeksjon (bakterier, sopp), lymfom, sarkoidose, IgG4 assosiert sykdom (IgG4-RD), Graves sykdom.
Embolier. Kolesterolembolier, antifosfolipid antistoff syndrom, atrialt myksom, og bakteriell endokarditt kan gi vaskulitt liknende tilstand.
Behandling
Nærmest alle behandlingsstudier inntil nylig publisert på MPA inkluderer pasienter med GPA og omvendt. Det vises til de franske anbefalingene som ble publisert i 2020 fra den fra den franske vaskulitt foreningen GFEV, Groupe Français D’étude des Vascularites (12), samt nyeste oppdaterte retningslinjer fra American College of Rheumatology (ACR) og Vasculitis Foundation (VF)som ble publisert i august 2021, 2021 ACR/VF Guideline for the Management of Antineutrophil Cytoplasmic Antibody-Associated Vasculitis (13). De nyeste Europeiske retningslinjene fra European League Against Rheumatism (EULAR). EULAR recommendations for the management of ANCA-associated vasculitis: 2022 update, som ble publisert tidlig i 2024 (14) og er etter mitt syn de aller beste retningslinjene som er tilgjengelig i dag. Det var også tidlig i 2024 publiserte fra nefrologisk ståsted,Kidney Disease: Improving Global Outcomes (KDIGO) 2024 Clinical Practice Guideline for the Management of Antineutrophil Cytoplasmic Antibody (ANCA)-Associated Vasculitis (38).
Viser nærmere til behandlingsretningslinjer fra Norsk Revmatologisk forening (NRF) oppdatert i 2024.
1. INDUKSJONSBEHANDLING
Ved alvorlig systemisk ny-diagnostisert eller alvorlig residiv av MPA
Første valg ved induksjonsbehandling ved MPA:
A: Glukokortikoid behandling:
Generelt innledes behandlingen med høydose steroid behandling. Som oftest intravenøs metylprednisolon/Solu-Medrol® 250-1000 mg daglig i 3 dager. Etterfulgt av per oral Prednisolon behandling etter PEXIVAS protokollen (15) (tabell 2). Dette har også vært tatt opp i de norske retningslinjene i behandling av ANCA assosierte vaskulitter.
Tidligere har det vært vanlig å gi pasienter plasmaferese som er fortsatt standard behandling ved Goodpasture syndrom. Randomiserte undersøkelser har ikke vist fordel med plasmaferese ved lungeblødninger ved ANCA vaskulitt. Det er antydning til at plasmaferese kan minske risikoen for nyresvikt hos de som har kreatinin over 300 ved metaanalyse men det øker risikoen for alvorlig infeksjon. (15-17)
Vært er å få med seg av den såkalte «lavdose» PEXIVAS steroid behandling har kun vært testet hos pasienter som har fått enten cyklofosfamid eller rituksimab (RTX) som induksjonsbehandling men kun rett over 15% av pasienter i studien fikk RTX, men ikke ved andre former av induksjonsbehandling som; mykofenolat (MMF) eller metotreksat (MTX) er ikke testet.
Tabell 2. Prednisolon nedtrapping etter lavdose PEXIVAS protokoll (15).
Hvis behandlingen innledes med SoluMedrol infusjon IV 250-1000mg IV kan man starte fra uke 1 som anført. Alternativt kan man gå rett til per oral prednisolon og da blir første uken (uke 1) 50 mg/d (<50kg), 60 mg/d (50-75kg) og 75 mg/d (>75kg) og deretter fra uke 2 som anført i skjema.
| Uke | <50kg | 50-75kg | >75kg |
| 1*-2 | 25 | 30 | 40 |
| 3-4 | 20 | 25 | 30 |
| 5-6 | 15 | 20 | 25 |
| 7-8 | 12,5 | 15 | 20 |
| 9-10 | 10 | 12,5 | 15 |
| 11-12 | 7,5 | 10 | 12,5 |
| 13-14 | 6,25 | 7,5 | 10 |
| 15-16 | 5 | 5 | 7,5 |
| 17-18 | 5 | 5 | 7,5 |
| 19-20 | 5 | 5 | 5 |
| 21-22 | 5 | 5 | 5 |
| 23-52 | 5 | 5 | 5 |
| >52 | Individuell behandling |
B: Avakopan (Tavenos®) er et alternativ ved glukokortikoid behandling:
Avakopan er molekyl som gis i tablettform og binder seg opp til komplement C5a reseptor 1 (C5aR1) og hindrer komplementfaktor C5a å sette seg på og stimulere reseptoren. ADVOCATE studien inkluderte 331 pasienter med MPA og GPA, og den er inntil nå verdens nest største behandlingsstudie på AAV der den kommer etter PEXIVAS studien med 704 pasienter inkluderte (32). Hemming av deler av komplementsystemet ser ut til å være paradigmeskifte i behandling av GPA og MPA og kan erstatte glukokortikoid behandlingen, som i stor grad forårsaker økt antall infeksjoner og komplikasjoner hos pasienter med AAV. Pasientene i ADVOCATE studien ble etter induksjonsbehandling randomiserte til å få enten konvensjonell per oral prednisolon behandling som ble faset ut i etter uke 21 og ble sammenlignet med per oral avacopan 30 mg x2 i kombinasjon med standard induksjonsbehandling med rituksimab eller cyklofosfamid. De primære endepunkter, remisjon i uke 26, viste ingen statistisk forskjell mellom avakopan (72,3%) og prednison (70,1%), men i uke 52 var signifikant bedre effekt av avakopan (65,7%) sammenlignet med prednison (54,9%). Risikoen for tilbakefall var signifikant større i gruppen som fikk per oral prednison. I tillegg viste studien det oppsiktsvekkende funn, at pasienter med AAV og nyreaffeksjon ved baseline som ble randomisert til avacopan hadde en signifikant større økning av eGFR sammenlignet med de som fikk prednison, der forskjellen var størst hos pasienter med en baseline eGFR < 20 ml/min /1,73 m2 (32) i tillegg har det vært påvist effekt på AVV pasienter som var i dialyse (33), men disse var ekskludert ADVOATE studien (32).
Avacopan var registrert av FDA for bruk i USA fra oktober 2021 og fra 2022 i Norge under navnet Tavenos®. Avakopan behandling er inkludert i de nyeste Europeiske behandlingsretningslinjene ved behandling av GPA og MPA der de kan erstatte per oral glukokortikoid behandlingen (14). Foreløpig er avakopan ikke uten videre tilgjengelig til norske pasienter hverken på H-resept eller §2. Beslutningsforum for nye metoder konkluderte den 28.8.2023 at det ikke var dokumentert at klinisk nytte stod i rimelig forhold til pris sammenlignet med per oral prednisolon behandling som er som kjent svært billig. Avakopan må søkes på individuell basis til medisinskfagdirektører særskilte grupper som vil profitere på avakopan/Tavenos og glukokortikoidfri behandling. Praktisk sett vil man da gi induksjonsbehandling med IV SoluMedrol behandling i 3 dager og gå over til per oral avokopan.
Avokopan er inkluderer bl.a. pasienter med; nyresvikt, diabetes mellitus, overvekt, osteoporose og pasienter med særlig økt infeksjonsrisiko som svært gamle og skrøpelige pasienter. Der avakopan vil sannsynligvis kunne redusere alvorlige komplikasjoner og forhindre langvarige innleggelser.
C: Plasmaferese?
Tidligere har det vært vanlig å gi pasienter med alvorlig nyreaffeksjon og/eller lungeblødninger som følge av AAV plasmaferese som er fortsatt standard behandling ved Goodpasture/anti-GBM syndrom. PEXIVAS us, er den største ANCA vaskulitt studien som har vært utført med inkluderte 704 pasienter, viste ingen fordel av plasmaferese ved lungeblødninger hos pasienter med GPA og MPA (15), eller signifikant effekt av plasmaferese ved nyreaffeksjon. Det er antydning til at plasmaferese kan minske risikoen for nyresvikt hos de som har kreatinin over 300 i metaanalyse som innebærer PEXIVAS samt flere mindre og eldre studier som anvender cyklofosfamid, men på den andre siden øker plasmaferese risikoen for alvorlig infeksjon (14, 15, 39).
D: Rituximab (RTX) og/eller cyklofosfamid (CYC)
Rituksimab er anti-CD20 antistoff behandling med intravenøst rituksimab behandling er per dags dato første valg ved AAV. RTX er kimært mus/humant monoklonalt antistoff, som består av et glykosylert immunglobulin human IgG1 konstant region og variable regioner fra mus. I to randomiserte studier RAVE og RITUXIVAS ble den såkalte «lymfomprotokoll» brukt. Da gis RTX intravenøs ukentlig til sammen i fire uker i doseringen 375mg/m2 overflate (17, 18). Fleste bruker den såkalte reumatoid artritt protokoll som består av intravenøs RTX 1.000 mg gitt 2 ganger med 2 ukers intervall. Det har ikke vært utført sammenligningsstudie på disse to protokollene, men en nylig utført metaanalyse presentert på American Collage of Rheumatology online kongressen i november 2020 viste ingen forskjell på disse to protokollene (19). [https://meet.acrconvergence.org/]
Vanlig prosedyre ved behandling med anti-CD20 antistoff behandling som RTX er å gi premedikasjon 30-60 min før RTX behandling. Den gjenstår i per oral paracetamol 1.000 mg x1, i tillegg histamin H1-reseptorantagonist, enten per oral cetirizin (10mg x1), eller intravenøs deksklorfeniramin 5 mg/ml 1ml IV. I tillegg gis oftest intravenøst metylprednisolon/Solu-Medrol® 125mg.
Det er dokumentasjon for bedre effekt av rituksimab (RTX) en cyklofosfamid/azathioprin (CYC/AXZA) hos PR3-ANCA positive pasienter i RAVE studien men lik effekt ved MPA (17, 20).
Hos pasienter som har ikke kommer i remisjon eller får residiv etter induksjonsbehandling med cyklofosfamid er RTX klart første valg. Generelt er RTX første valg hos pasienter i reproduktiv alder i tillegg hos de som tidligere har hatt malign sykdom.
D2. Cyclofosfamid (Sendoxan®):
Cyclofosfamid (Sendoxan®) er et alkylerende cytostatikum. Medikamentet er en sennepsgassanalog om griper inn i G1- og S-fasen i cellesyklusen med å alkylere DNA-kjedene og hemme immunologisk respons. Intravenøs eller per oral cyklofosfamid evt. er et godt kjent behandlingsalternativ for AAV.
Intravenøs cyklofosfamid behandling: De fleste bruker intravenøs cyklofosfamid etter CYCLOPS/EUVAS protokollen (21). Det er generell trend til å bruke intravenøs cyklofosfamid der dette gir lavere kumulativ dosering en ved per oral behandling. Standarddoseringen ved intravenøs behandling er 15 mg/kg med maksimal dosering på 1.200 mg cyklofosfamid per behandlingsrunde og med redusert dosering i henhold til alder (<60 år: 15 mg/kg, 60-70 år: 12,5 mg/kg og >70 år: 10 mg/kg). Det er også redusert dosering mht. alvorlig nyresvikt (definert som kreatinin >300 eller eGFR ≤30) der man reduserer doseringen med 2,5 mg/kg som kommer i tillegg til reduksjon i henhold til alder (<60 år: 12,5 mg/kg, 60-70 år: 10 mg/kg og >70 år: 7,5 mg/kg) (Tabell 3)
Tabell 3. Doseendring av intravenøs cyklofosfamid relatert til alder / nyrefunksjon
| Intravenøs cyklofosfamid puls (mg/kg)
(Max 1200 mg/puls) |
||
| Alder (år) | Kreatinin ≤ 300(μmol/L) eller
eGFR > 30 (ml/min/1,73m2) |
Kreat. > 300
eGFR: ≤ 30 |
| < 60 | 15 mg/kg | 12,5 mg/kg |
| 60 – 70 | 12,5 mg/kg | 10,0 mg/kg |
| > 70 | 10,0 mg/kg | 7,5 mg/kg |
De første tre doseringene gis med to ukers intervall og neste tre, eller flere, med tre ukers intervall. Uke 0, 2, 4, 7, 10 og 13 og hvis ikke remisjon uke 16, 19 etc.
Ved økt benmargshemming må man vurdere å utsette behandling og evt. redusere doseringen.
Det er viktig med god hydrering og spesial oppmerksomhet ved urinretensjon og å gi behandlingen tidlig om dagen med intravenøs væske behandling.
Antiemetisk behandling anvendes og da oftest intravenøs selektiv 5-HT3-reseptorantagonist, for eksempel intravenøs ondansetron 8 mg som kan gjentas ved forsinket kvalme.
Ved intravenøs cyklofosfamid behandling gis vanligvis profylaktisk behandling med intravenøs forut og senere to ganger per oral mesna (Uromitexan®) som reduserer dannelsen av akrolein i urinen og minsker risiko for bivirkning fra urinveier som gis forut og to ganger etterpå. Generelt gir man 20% (0,2 x cyclofosfamid doseringen i mg) intravenøst forut og 40% (0,4 x cyclofosfamid doseringen i mg) gjentatt to ganger.
For eksempel pasienten som får 900 mg cyklofosfamid får 0,2 x 900 = 180 mg IV Uromitexan® og 0,4 x 900 = 360 mg ≈ 400 mg per oral. Det finnes 400 mg og 600 mg Uromitexan® tabletter som har delstrik.
Per oral cyklofosfamid behandling: Valg av per oral cyklofosfamid behandling kan vurderes og vanlig doseringen er 2 mg/kg gitt tidlig om dagen i en dosering. Sendoxan tabletter er på 50 mg og uten delestrek.
Det er liknende dosereduksjon i henhold til alder og nyresvikt som ved intravenøs behandling (Tabell 4)
Tabell 4. Doseendring av per oral cyklofosfamid relatert til alder / nyrefunksjon
| Daglig per oral cyclofosfamid (mg/kg)
(Max 200 mg/dag) |
||
| Alder (år) | Kreatinin ≤ 300(μmol/L) eller
eGFR > 30 (ml/min/1,73m2) |
Kreat. > 300
eGFR: ≤ 30 |
| < 60 | 2,0 mg/kg | 1,5 mg/kg |
| 60 – 70 | 1,5 mg/kg | 1,25 mg/kg |
| > 70 | 1,25 mg/kg | 1,0 mg/kg |
E: Tredje valg ved induksjonsbehandling ved GPA:
Kan vurderes anvendt hos mindre syke GPA pasienter.
E1 Mykofenolat mofetil (MMF): Dosering: 2-3 g/d fordelt på to doseringer, med ca. 12 timers intervall. Det er tabletter på 500 mg og kapsler på 250 mg i tillegg finnes MMF i mikstur. Alternativt til MMF er mykofenolsyre/Myfortic (MPA) der doseringen er 360 mg x2 eller 750mg x2. MMA kan ha noe mindre gastrointestinal bivirkninger en MMF men virkningsmekanismen er lik.
Generelt vil man ikke anvende MMF som induksjonsbehandling hos de sykeste pasientene. Som induksjonsbehandling hos de AAV pasienter med mindre alvorlig sykdom kommer MMF brukbart ut i hvert fall sammenlignet med cyklofosfamid i en nylig publisert randomisert studie (22). MMF var initialt ikke statistisk dårligere en cyklofosfamid, men induksjonsbehandling med MMF resulterte høyere andel tilbakefall spesielt hos PR3-ANCA positive AAV pasienter. Som vedlikeholdsbehandling kommer MMF dårligere ut i en randomisert «head-to-head» studie mot azathioprin (23). Hos MPA pasienter med ILD kan og lavgradig nefritt kan MMF være et valg.
E2 Metotreksat (MTX): MTX p.o. eller s.c. i ukentlig dosering er medikament som brukes i et stort omfang innen revmatologien noe alle revmatologer er og bør være kjent med. Generelt er MTX s.c. er å foretrekke, der det gir mer stabil blodverdi. Vanlig dosering er opp mot ca. 0,3 mg/kg/uke (15-25 mg) og ofte trapper man gradvis opp mot måldosering over noen uker. Det har vært tradisjon i Europa å gi samtidig folsyre tilskudd for å redusere bivirkninger ofte 1 mg Folsyre daglig.
En Europeisk studie sammenlignede mindre syke pasienter med AAV uten nyresvikt (kreatinin < 150 µmol/L) behandling med MTX og cyklofosfamid (CYC). Resultater var at det gikk noe lengre tid å komme i remisjon med MTX og til tross antall av de som kom i remisjon var ikke signifikant dårligere en CYC var det stor forskjell på hyppighet av tilbakefall mellom de to induksjonsbehandlingene. Der var nesten 70% som fikk tilbakefall av de som fikk MTX vs. 47% av de som fikk CYC som induksjonsbehandling etter 18 måneder (24).
Per dags dato kan man vurderer man MTX og evt. MMF som induksjonsbehandling sammen med steroid behandling ved mindre alvorlig form av AAV.
2. VEDLIKEHOLDSBEHANDLING
Det er foreløpig ikke helt klart hvor lenge vedlikeholdsbehandlingen ved MPA skal vare og sannsynligvis og der må gjøres individuell evaluering. Vedlikeholdsbehandlingen bør i hvert fall vare i minst 2 år, men betydelig del av pasientene trenger behandling adskillig lengre opp til 4-5 år og i noen ganger muligvis enda lengre. Det er foreløpig ikke noe entydig svar på dette. Det er balanse mellom residivfare og bivirkninger av langvarig immunsuppresjon og individuell risiko for det. Den franske REMAIN studie viste at 4 års vedlikeholdsbehandling var bedre en 2 års. Der fikk nærmere tre ganger flere tilbakefall av de som fikk vedlikeholdsbehandling i 2 år versus de som fikk det i 4 år (63% mot 22%, p <0,0001) (25).
De som får induksjonsbehandling med rituksimab (RTX) med god toleranse. Der vil man fortsette med RTX hver 6. måned. Det er påvist at IV RTX er betydelig bedre får å forhindre tilbakefall en konvensjonell azathioprin (AZA) behandling. En tidligere undersøkelser har vist at AZA er overlegen mykofenolat mofetil (MMF) når det gjelder å hindre tilbakefall ved GPA (23), men MMF kan vurderes hvis intoleranse for AZA. Det er forskjellige tradisjoner mellom land i henhold til vedlikeholdsbehandling med lavdose steroider. I flere land i Europa har man brukt lavdose Prednisolon dvs. dosering rundt 5 mg/d over noe lengre tid. Det foregår studier for å se på dette i henhold til bivirkninger og fare for tilbakefall. En amerikansk studie ser på dette kalles TAPIR studien “The Assessment of Prednisone in Remission Trial” og resultatene ventes innen 1-2 år (NCT01933724). I tillegg foregår den franske MAINEPSAN studien “Evaluate the Remission MAINtenance Using Extended Administration of Prednisone in Systemic Anti-neutrophil Cytoplasmic Antibodies Associated Vasculitis” (NCT03290456) som går ut på det samme der resultatene forventes 2024-2025.
A: Rituksimab (RTX): Forutsatt at man har igangsatt induksjon med RTX med god toleranse vil man som oftest fortsette med den behandlingen som vedlikeholdsbehandling. Sammenlignet med vedlikeholdsbehandling kommer RTX bedre ut når det gjelder risiko for tilbakefall. Det er tre publiserte studier fra GFEV, den franske vaskulitt foreningen. Alle studiene anvender RTX 500 mg hver 6. måned i fast dosering (25-28). Endelig data fra RITAZAREM studie bruker betydelig høyrere dosering på 1000 mg hver 4. måned er foreløpig ikke blitt publisert men har vært presentert og viser betydelig forskjell til fordel av RTX sammenlignet med AZA. Kun første del av RITAZEREM studien er foreløpig publisert (29) men resultatene har vært presentert og kjent.
Vedr. vedlikeholdsbehandling velger anbefaler både Norsk revmatologisk forening (NRF) og andre inklusiv den franske GFEV å anvende RTX 500 mg hver 6. måned som vedlikeholdsbehandling. Hvis det ikke er toleranse for RTX vil man i neste omgang vurdere å bruke AZA og deretter metotreksat forut mykofenolat mofetil som er eventuelt tredje valg og per oral leflunomid som evt. fjerde valg.
B: Azathioprin (AZA) – Imurel® doseres oftest rundt 2 mg/kg i en enkel dosering. Imurel finnes i 50 mg og 25 tabletter og det går ikke å dele dem. Man anbefaler å ta tiopurin methyltransferase (TPMT) genotype forut behandling. De fleste (rundt 90 %) har TPMT*1/*1 (wild-type) genotype med normal TPMT enzym aktivitet og kan få vanlig dosering, 2,0-2,5 mg/kg per dag en gang på dagen. Pasienter som er heterozygote med TPMT*1 og noen av de over 20 TPMT polymorfismene, som oftest er *2, *3A, *3B, *3C, og *4, har redusert TPMT enzym aktivitet og må få redusert, oftest halvert dosering og følges grundig hvis oppstart. De som ikke har TPMT*1genotypen og enten homozyg og/eller heterozygot for en av de allelene bør ikke få azathioprin i hele tatt pga. økt risiko for alvorlig myelosuppresjon. Dette utgjør få pasienter (>1%). Vises til Avdeling for farmakologi. Oslo universitetssykehus.
Verdi av 6-tioguaninnukleotide (6-TGN) og metyl-merkaptopurin (me-MP) måles i heparinisert fullblod, tilsier om effekt av AZA behandlingen. Terapeutisk område er: 6-TGN 3,5−5,0 µmol/L og me-MP <50 µmol/L når brukes i transplantasjonsmedisin. Dette kan anvendes i kontroll med blodprøve. (Se https://anx.no/6tgn/)
Infeksjonskomplikasjoner:
Dette er et relativt stort problem ved immunsuppressiv behandling av GPA og bor behandles aggressivt. Ved langvarig immunsuppresjon anbefales profylaktisk behandling for Pneumocystis jiroveci pneumoni (PJP). Det finnes forskjellige alternativer for forebyggende behandling. Ofte brukes per oral Bactrim (SMZ-TMP) (400 mg sulfamethoxazol og 80 mg trimetoprim) daglig. Alternativt er Dapson 50-100 mg/d, det tredje alternativet er pentamidin inhalasjon enten en gang i måneden (300 mg) eller hver annen hver uke (150 mg). Det er sjelden alvorlige bivirkninger med inhalasjonsbehandling. Men den kan ofte gi hoste, bronkospasme, samt og smaksforandringer og uvelfølelse.
Det er økt risiko for PJP når pasienten tidligere har hatt PJP, økt alder over 65 år, påvist lungesykdom eller omfattende lungeaffeksjon av AAV, ved høy glukokortikoid dosering særlig ved Prednisolon over 20 mg/d og også hos pasienter med redusert CD4+ T-lymfocytt-tall særlig hos de som ligger under 200 x106 celler/liter. Flere risikofaktorer styrker behandlingsindikasjonen ytterligere.
Hypogammaglobulinemi kan sees ved AAV og det er definert flere risikofaktorer bl.a. lav IgG forut start og cyklofosfamid behandling før eller med rituksimab behandling. Det er assosiasjon mellom dose og lengde av RTX behandling og hypogammaglobulinemi. Det anbefales at man kontroller gammaglobulinkonsentrasjon ved oppfølging. Moderat hypogammaglobulinemi er ofte definert hos de som har IgG 3,0 – 4,9 g/L og alvorlig de som har IgG < 3,0 g/L. Hvis det foreligger i tillegg økt infeksjonsrisiko er det klar indikasjon for substitusjonsbehandling med sc. eller iv. gammaglobulin substitusjon.
Prognose
Ubehandlet MPA gir en pasientoverlevelse på mindre enn 20% etter 5 år (34). Selv om risikoen for tilbakefall er lavere for MPA sammenlignet med GPA, er pasientens overlevelse lavere for MPA enn for GPA og EGPA.
Anbefalt litteratur
- Kronbichler, A., et al. (2024). “Diagnosis and management of ANCA-associated vasculitis.” Lancet 403(10427): 683-698.
- Trivioli, G., et al. (2022). “Genetics of ANCA-associated vasculitis: role in pathogenesis, classification and management.” Nat Rev Rheumatol 18(10): 559-574
- Kitching AR, et al. ANCA-associated vasculitis. Nature Reviews Disease Primers. 2020;6(1):71.
- Wallace ZS, Miloslavsky EM. Management of ANCA associated vasculitis. BMJ. 2020;368:m421.
- Bokkapittel: Sinico RA, et al. Microscopic Polyangiitis. In: Sinico RA, Guillevin L, editors. Anti-Neutrophil Cytoplasmic Antibody (ANCA) Associated Vasculitis. Cham: Springer International Publishing; 2020. p. 131-44
Referanser
- Lyons PA. Genetically distinct subsets within ANCA-associated vasculitis. N Engl J Med. 2012;367:214-23.
- Lyons PA, Peters JE, Alberici F, Liley J, Coulson RMR, Astle W, et al. Genome-wide association study of eosinophilic granulomatosis with polyangiitis reveals genomic loci stratified by ANCA status. Nat Commun. 2019;10(1):5120.
- Merkel PA, Xie G, Monach PA, Ji X, Ciavatta DJ, Byun J, et al. Identification of Functional and Expression Polymorphisms Associated With Risk for Antineutrophil Cytoplasmic Autoantibody-Associated Vasculitis. Arthritis & rheumatology (Hoboken, NJ). 2016.
- Xie G, Roshandel D, Sherva R, Monach PA, Lu EY, Kung T, et al. Association of granulomatosis with polyangiitis (Wegener’s) with HLA-DPB1*04 and SEMA6A gene variants: evidence from genome-wide analysis. Arthritis Rheum. 2013;65(9):2457-68.
- Berti A, Cornec D, Crowson CS, Specks U, Matteson EL. The Epidemiology of Antineutrophil Cytoplasmic Autoantibody-Associated Vasculitis in Olmsted County, Minnesota: A Twenty-Year US Population-Based Study. Arthritis & rheumatology (Hoboken, NJ). 2017;69(12):2338-50.
- Jennette JC, Falk RJ, Bacon PA, Basu N, Cid MC, Ferrario F, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis Rheum. 2013;65(1):1-11.
- Watts R, Lane S, Hanslik T, Hauser T, Hellmich B, Koldingsnes W, et al. Development and validation of a consensus methodology for the classification of the ANCA-associated vasculitides and polyarteritis nodosa for epidemiological studies. Ann Rheum Dis. 2007;66(2):222-7.
- Luqmani RA, Bacon PA, Moots RJ, Janssen BA, Pall A, Emery P, et al. Birmingham Vasculitis Activity Score (BVAS) in systemic necrotizing vasculitis. QJM. 1994;87(11):671-8.
- Mukhtyar C, Lee R, Brown D, Carruthers D, Dasgupta B, Dubey S, et al. Modification and validation of the Birmingham Vasculitis Activity Score (version 3). Ann Rheum Dis. 2009;68(12):1827-32.
- Exley A, Bacon P, Luqmani R, Kitas G, Gordon C, Savage C, et al. Development and initial validation of the Vasculitis Damage Index for the standardized clinical assessment of damage in the systemic vasculitides. Arthritis Rheum. 1997;40:371 – 80.
- Lillejordet E, Rashid HU, Evang JA, Taraldsrud E, Gunnarsson R. A woman in her forties with influenza symptoms and swollen arm. Tidsskr Nor Laegeforen. 2019;139(1).
- Terrier B, Charles P, Aumaître O, Belot A, Bonnotte B, Crabol Y, et al. ANCA-associated vasculitides: Recommendations of the French Vasculitis Study Group on the use of immunosuppressants and biotherapies for remission induction and maintenance. Presse medicale (Paris, France : 1983). 2020;49(3):104031.
- Chung SA, Langford CA, Maz M, Abril A, Gorelik M, Guyatt G, et al. 2021 American College of Rheumatology/Vasculitis Foundation Guideline for the Management of Antineutrophil Cytoplasmic Antibody-Associated Vasculitis. Arthritis Rheumatol. 2021;73(8):1366-83.
- Hellmich B, Sanchez-Alamo B, Schirmer JH, Berti A, Blockmans D, Cid MC, et al. EULAR recommendations for the management of ANCA-associated vasculitis: 2022 update. Ann Rheum Dis. 2024;83(1):30-47.
- Walsh M, Merkel PA, Peh CA, Szpirt WM, Puechal X, Fujimoto S, et al. Plasma Exchange and Glucocorticoids in Severe ANCA-Associated Vasculitis. N Engl J Med. 2020;382(7):622-31.
- Cartin-Ceba R, Diaz-Caballero L, Al-Qadi MO, Tryfon S, Fervenza FC, Ytterberg SR, et al. Diffuse Alveolar Hemorrhage Secondary to Antineutrophil Cytoplasmic Antibody-Associated Vasculitis: Predictors of Respiratory Failure and Clinical Outcomes. Arthritis & rheumatology (Hoboken, NJ). 2016;68(6):1467-76.
- Stone J, Merkel P, Spiera R, Seo P, Langford C, Hoffman G, et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med. 2010;363:221 – 32.
- Jones R, Tervaert J, Hauser T, Luqmani R, Morgan M, Peh C, et al. Rituximab versus cyclophopshamide in ANCA-associated renal vasculitis. N Engl J Med. 2010;363:211 – 20.
- Benard V, Farhat C, Zarandi-Nowroozi M, Durand M, Pagnoux C, Charles P, et al. Comparison of Two Rituximab Regimens for Induction of Remission in Antineutrophil Cytoplasm Antibody-associated Vasculitis: Systematic Review and Meta-analysis [abstract]. American College of Rheumatology Convergence 2020; 2020; Virtual. Arthritis Rheumatol. 2020; 72 (suppl 10). Arthritis Rheumatol.; 2020.
- Unizony S, Villarreal M, Miloslavsky EM, Lu N, Merkel PA, Spiera R, et al. Clinical outcomes of treatment of anti-neutrophil cytoplasmic antibody (ANCA)-associated vasculitis based on ANCA type. Ann Rheum Dis. 2016;75(6):1166-9.
- de Groot K, Harper L, Jayne DR, Flores Suarez LF, Gregorini G, Gross WL, et al. Pulse versus daily oral cyclophosphamide for induction of remission in antineutrophil cytoplasmic antibody-associated vasculitis: a randomized trial. Ann Intern Med. 2009;150(10):670-80.
- Jones RB, Hiemstra TF, Ballarin J, Blockmans DE, Brogan P, Bruchfeld A, et al. Mycophenolate mofetil versus cyclophosphamide for remission induction in ANCA-associated vasculitis: a randomised, non-inferiority trial. Ann Rheum Dis. 2019;78(3):399-405.
- Hiemstra TF, Walsh M, Mahr A, Savage CO, de Groot K, Harper L, et al. Mycophenolate mofetil vs azathioprine for remission maintenance in antineutrophil cytoplasmic antibody-associated vasculitis: a randomized controlled trial. JAMA. 2010;304(21):2381-8.
- De Groot K, Rasmussen N, Bacon P, Tervaert J, Feighery C, Gregorini G, et al. Randomized trial of cyclophosphamide versus methotrexate for induction of remission in early systemic antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Rheum. 2005;52:2461 – 9.
- Karras A, Pagnoux C, Haubitz M, Groot K, Puechal X, Tervaert JWC, et al. Randomised controlled trial of prolonged treatment in the remission phase of ANCA-associated vasculitis. Ann Rheum Dis. 2017;76(10):1662-8.
- Guillevin L, Pagnoux C, Karras A, Khouatra C, Aumaitre O, Cohen P, et al. Rituximab versus azathioprine for maintenance in ANCA-associated vasculitis. N Engl J Med. 2014;371(19):1771-80.
- Terrier B, Pagnoux C, Perrodeau E, Karras A, Khouatra C, Aumaitre O, et al. Long-term efficacy of remission-maintenance regimens for ANCA-associated vasculitides. Ann Rheum Dis. 2018;77(8):1150-6.
- Charles P, Terrier B, Perrodeau E, Cohen P, Faguer S, Huart A, et al. Comparison of individually tailored versus fixed-schedule rituximab regimen to maintain ANCA-associated vasculitis remission: results of a multicentre, randomised controlled, phase III trial (MAINRITSAN2). Ann Rheum Dis. 2018;77(8):1143-9.
- Smith RM, Jones RB, Specks U, Bond S, Nodale M, Aljayyousi R, et al. Rituximab as therapy to induce remission after relapse in ANCA-associated vasculitis. Ann Rheum Dis. 2020.
- Jayne, D. R. W., et al. (2017). “Randomized Trial of C5a Receptor Inhibitor Avacopan in ANCA-Associated Vasculitis.” J Am Soc Nephrol 28(9): 2756-2767.
- Merkel PA, Niles J, Jimenez R, Spiera RF, Rovin BH, Bomback A, et al. Adjunctive Treatment With Avacopan, an Oral C5a Receptor Inhibitor, in Patients With Antineutrophil Cytoplasmic Antibody-Associated Vasculitis. ACR Open Rheumatol. 2020;2(11):662-71.
- Jayne DRW, Merkel PA, Schall TJ, Bekker P, Group AS. Avacopan for the Treatment of ANCA-Associated Vasculitis. The New England journal of medicine. 2021;384(7):599
- Cortazar FB, Niles JL, Jayne DRW, Merkel PA, Bruchfeld A, Yue H, et al. Renal Recovery for Patients with ANCA-Associated Vasculitis and Low eGFR in the ADVOCATE Trial of Avacopan. Kidney Int Rep. 2023;8(4):860-70.
- Cortazar FB, Cerda J, Dhanani R, Roglieri J, Santoriello D. Avacopan in Patients With Rapidly Progressive Glomerulonephritis Requiring Dialysis. Kidney Int Rep. 2023;8(8):1687-91.
- Robson JC, Grayson PC, Ponte C, Suppiah R, Craven A, Judge A, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for granulomatosis with polyangiitis. Ann Rheum Dis. 2022;81(3):315-20.
- Grayson PC, Ponte C, Suppiah R, Robson JC, Craven A, Judge A, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology Classification Criteria for Eosinophilic Granulomatosis with Polyangiitis. Ann Rheum Dis. 2022;81(3):309-14.
- Suppiah R, Robson JC, Grayson PC, Ponte C, Craven A, Khalid S, et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for microscopic polyangiitis. Ann Rheum Dis. 2022;81(3):321-6.
- Kidney Disease: Improving Global Outcomes, A. V. W. G. (2024). “KDIGO 2024 Clinical Practice Guideline for the Management of Antineutrophil Cytoplasmic Antibody (ANCA)-Associated Vasculitis.” Kidney Int 105(3S): S71-S116.
- Walsh M, Collister D, Zeng L, Merkel PA, Pusey CD, Guyatt G, et al. The effects of plasma exchange in patients with ANCA-associated vasculitis: an updated systematic review and meta-analysis. Bmj. 2022;376:e064604.

