BINDEVEVSSYKDOMMER (REV 021-033)
41 Epidemiologi, Genetikk, Patogenese og Manifestasjoner ved Systemiske Bindevevssykdommer (REV 021)
Jan Tore Gran and Øyvind Palm
Epidemiologi
Epidemiologi er læren om sykdomsforekomst i ulike grupper av befolkninger, variabler for sykdomsvariasjon og hvordan sykdom kan kontrolleres (BMJ, 2023). Epidemiologien ved systemiske bindevevssykdommer forteller oss for eksempel at sykdommene er mer sannsynlig hos kvinner enn menn og sykdomsdebut etter 60 års alder er svært uvanlig. Systemiske (autoimmune) bindevevssykdommer er sjeldne, men potensielt livstruende tilstander som ofte angriper hud, slimhinner, lunger, nyrer, eksokrine kjertler, muskler og ledd. Epidemiologisk vet vi at de kan oppstå i alle aldre, men vanligst blant unge voksne. Sykdommene forekommer blant alle befolkninger, men varierer avhengig av etnisitet og miljøfaktorer (Parks CG, 2017). Dermed bidrar epidemiologisk kunnskap til strategier for forebygging, diagnostisering og oppfølging av sykdommene. Vi har derfor integrert avsnitt om epidemiologi i de aller fleste kapitlene som beskriver de ulike sykdommene i Kompendiet.
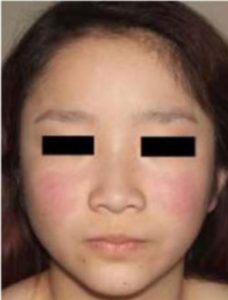
Innen sammenlignbare befolkninger påvises ofte ulik forekomst. Årsaken kan være epidemiologisk, men også avhengig av metode-forskjeller i studiene. Av størst betydning er studienes varighet, klassifikasjons-kriterier for diagnosene og om studiene er basert på befolkninger (befolknings-studier) eller et selektert pasientmateriale, for eksempel fra over-regionale spesialavdelinger (Gaubitz M, 2006). De tre vanligste systemiske bindevevssykdommene er primært Sjøgrens syndrom, systemisk lupus erythematosus (SLE) og antifosfolipid syndrom (vennligst se tabellen nedenfor).
Longitudinelle data gjør at vi kan se endringer i forekomst over tid/epidemiologiske trender. Ved SLE viste en populasjons-basert studie over en periode på 42 år (1950-1992) en nesten tre ganger økt forekomst. En observerte samtidig at dødeligheten sank, men forble likevel høyere enn i den generelle befolkningen (Uramoto KM, 1999). Forklaringer på redusert dødelighet ved SLE er tidligere diagnose, diagnostisering av mildere tilfeller, økt bruk av antistoff-tester (ANA med sub-grupper) og bedre behandling (Gabriel SE, 2009). Norske data indikerer at nyreaffeksjon er en vesentlig faktor for alvorlig sykdomsforløp og økt mortalitet (Reppe Moe SE, 2019).
Sjøgrens syndrom har vært definert ved mer enn 10 ulike klassifikasjonskriterier de siste ti-årene, noe som gjør sammenligninger mellom studier vanskelig. En norsk studie sammenlignet prevalens ved bruk av de mindre strenge preliminære europeiske kriterier av 1993 (Vitali C, 1993) og de noe strengere reviderte kriterier av 1996. I aldersgruppen 40-44 år var prevalens av Sjøgrens på henholdsvis 0,44% og 0,22%. I aldersgruppen 71-74 var prevalensen henholdsvis 3,39% og 1,40%. Studien viste også en syv-dobling av forekomsten mellom aldersgruppene (Haugen AJ, 2007). Til sammenligning viste en nyere studie, basert på de mer aktuelle og enda strengere AECG kriteriene (Vitali C, 2002) er lavere prevalens estimert til 0,05% i Rogaland og Hordaland. Gjennomsnittsalderen ved undersøkelsen var 61,6 år (Gøransson LG 2011).
Epidemiologi generelt er omtalt i kapitlet om Epidemiologi, forskning og statistikk.
| Epidemiologiske data for systemiske bindevevssykdommer | |||
| Diagnose | Prevalens | Insidens | Referanse |
| SLE | 52 / 100.000 | 3,0 / 100.000 | Lerang K, 2012 |
| ApLs | 50 / 100.000 | 2,1 / 100.000 | Duarte-Garcia A, 2019 |
| Sjøgrens | 50 / 100.000 | 7,0 / 100.000 | Göransson LG, 2011. Qin B, 2015 |
| MCTD | 2,1 / 100.000 | 1,9 / 100.000 | Gunnarsson R, 2011 |
| Systemisk sklerose | 9,9 / 100.000 | 13,9 / million | Hoffmann-Vold A-M, 2012. Steen VD, 2005 |
| Myositt (DM, PM) | 8,7 / 100.000 | 6-10 million | Dobloug C, 2015 |
Genetiske forhold
Immunsystemets oppbygging, styrker og defekter varierer på bakgrunn av genetiske ulikheter og miljøfaktorer med individuelle variasjoner. Disse forklarer delvis individuelt ulike responser på infeksjoner og forskjellig risiko for autoimmune sykdommer. Genetikk er også årsak til ulik sykdomsforekomst og forløp mellom etniske befolkningsgrupper, illustrert ved systemisk lupus (SLE) som er mer utbredt og alvorlig blant asiater enn etnisk norske.
Enkelte tilstander innen revmatologi kan også oppstå som følge av genetiske endringer / mutasjoner i løpet av livet. Et eksempel er vaskulitt-sykdommen VEXAS syndrom som ble beskrevet ganske nylig. Årsaken til slike genetiske endringer er oftest ukjent. In noen tilfeller er miljøfaktorer av betydning. Forståelse av genetikk og vårt hele genom med de individuelle variasjonene essensielle for å avdekke nye kurative behandlingsformer og forebyggende tiltak, også innen fremtidig revmatologi (Jackson M, 2018).
Generelt (basert på: Martinsen L, Store Norske Leksikon, 26.03.2021).
Gener kalles også kalt arveanlegg og er avgrensede områder på DNA-molekylet som har en bestemt oppgave i en organisme. Genene inneholder oppskrifter for ulike produkter som gir oss de egenskapene vi har. Vi sier gjerne at gener koder for egenskaper.
Alleler. Gener kan komme i ulike varianter, og hver variant kalles et allel. Vi har ett allel fra mor og ett allel fra far (diploide) og således to sett kromosomer. Dersom de to allelene er helt like kalles individet en homozygot. Dersom de to allelene er forskjellige kalles individet en heterozygot.
Kromosomer. Mesteparten av genene befinner seg i cellekjernenes kromosomer. Det enkelte kromosom består av ett langt DNA-molekyl. Genene er ordnet på rekke og rad på kromosomene. Noen gener som disponerer for autoimmunitet er lokalisert på X-kromosomet. Kvinners dobbelte X kromosomer (XX) er medvirkende årsak til kvinners økte forekomst av autoimmune sykdommer (Billi AC, 2019). Videre er det vist at menn med Klinefelter syndrom (karyotype XXY) har økt risiko for (Scofield RH,2008), og en mannlig pasient med alvorlig pre-pubertal SLE viste seg å ha en XX karyotype på grunn av X-Y translokation (Chagnon P, 2006).
Genotype og Fenotype. Summen av alle gener og genenes alleler (genvarianter) kalles individets genotype som er den totale genetiske sammensetningen til et individ. De ytre egenskapene til organismene kalles fenotype. Disse omfatter også sykdomsmanifestasjoner. Altså, det vi ser er fenotype, mens det vi ikke ser – de underliggende genene – kalles genotype. For systemiske bindevevssykdommer er bestemmelse av genotyper oftest uinteressant. For revmatologen som vurderer juvenil SLE, autoinflammatoriske sykdommer, Marfans sykdom, Ehlers-Danlos syndrom, Loeys-Dietz syndrom, DaDa2/juvenil PAN, Sneddons syndrom, VEXAS, non-inflammatoriske myopatier med flere er genotype av diagnostisk interesse (Kacar M, 2019).
Dominante og Recessive gener. En av de viktigste oppdagelsene Gregor Mendel gjorde var at noen gen-utgaver dominerer over andre (dominante gener versus recessive). De fleste egenskaper, inklusiv disposisjon for sykdommer har imidlertid vist seg å være mer kompliserte. Egenskaper der det ene arveanlegget (allel) fullstendig overskygger det andre ser man ikke så ofte. Når en egenskap er en blanding av to karaktertrekk istedenfor at den ene dominerer over den andre, kalles ufullstendig dominans.
Polygenetisk. Det er ofte flere gener, ikke bare ett, som avgjør hvordan en egenskap skal se ut. Disse genene kan påvirke hverandre og det endelige resultatet vil være avhengig av hvilke genvarianter som finnes i ett og samme individ, og nøyaktig hvordan de påvirker hverandre. Disposisjoner for systemiske bindevevssykdommer er trolig av polygenetisk natur.
Mutasjoner. Innen enkeltindivider kan arveanleggene endres ved mutasjoner. Dette kan føre til en endring i en egenskap hos individet som bærer det muterte genet, eller endringen kan nedarves og effekten først komme til syne hos avkommet. Mutasjon i voksen alder med påfølgende sykdomsutvikling hos individet er kjent ved VEXAS syndrom.
Epigenetikk er vitenskapen om arvbare, reversible endringer i genenes aktivitet uten at rekkefølgen på DNA-sekvensen endrer seg. Det er sannsynlig at epigenetikk er av betydning for utvikling av en del autoimmune revmatiske sykdommer (Ray D, 2018).
Tvillingstudier viser betydning av genetikk og miljø-faktorer. Eneggede tvillinger er genetisk identiske og har dermed i utgangspunktet lik risiko for utvikling av revmatisk sykdom. To-eggede tvillinger er genetisk forskjellige som andre søsken. Ved monogene genetiske sykdommer forventes at eneggede tvillinger nesten alltid utvikler samme sykdom (nær 100% konkordanse). For multigenetiske sykdommer, varierer forekomsten av samme sykdom hos begge en-eggede tvillinger mellom 5 og 70% og er lavere for to-eggede, noe som illustrerer betydningen av både genetikk og miljøfaktorer. Eneggede tvillinger har 24-25% risiko for SLE dersom den ene blir syk (Grennan DM 1997). Tilsvarende blant andre søsken (av samme kjønn) er 2-6% og ca. 8% for første grads slekt samlet.
Polyautoimmunitet. Ofte påvises flere ulike autoimmune sykdommer i samme slekten. Tilstanden kalles samlet sett multipel autoimmunt syndrom (MAS) (Anaya JM, 2007). For eksempel har 11% med SLE, en nær slektning med autoimmun sykdom. Gen-studier har vist at genene PTPN22 og STAT4 er knyttet til risiko for ulike autoimmune sykdommer som SLE, systemisk sklerose og revmatoid artritt.
Behandling av gendefekter og antigen. I teorien kan helbredelse for de fleste genetisk sykdommer oppnår, forutsatt at en finner tekniske løsninger og individuelle tilpasninger. Spesielt er CRISPER-redigering en lovende metode som målrettet finner, kutter og reparerer biter i arvematerialet. man kan ødelegge skadet DNA og innsetter nytt arvemateriale (Valen E, 2022). Kimerisk antigenreseptor-T-celleterapi (CAR-T cellebehandling) er et nytt, svært potent behandlingsprinsipp under utprøving i revmatologi. Metoden benytter genteknologi til å modifisere T-celler slik at de gjenkjenner spesifikke antigen på B-cellers overflate. CAR-T cellebehandling stammer fra kreftbehandling mot B-celleleukemi og lymfom (Schuster SJ, 2017). Rettet mot CD-19 celler (anti-CD-19 CAR-T) har behandlingen vist svært god effekt mot alvorlig SLE.
Gentester. Eksempler på gen-tester: NIPT (Non-Invasive Prenatal Testing), karyotype (kromosomundersøkelse), exome-sekvensering (protein-kodende gener i det humane genom), Sanger-sekvensering analyserer et spesifikt gen eller en spesifikk region av genomet, paneltester, helgenomsekvensering og transkriptomanalyse, blir stadig mer tilgjengelige.
- For informasjon om aktuelle genetiske tester er gentikkportalen.no aktuell.
Utfyllende litteratur: Rheumatology.org, 2020; Jackson M, 2018
Patogenese
Systemiske bindevevssykdommer kan delvis forårsakes av genetisk disposisjon (arvelighet), men også miljøfaktorer. Slike ikke-arvelige faktorer kan omfatte eksponering for kjemikalier og sigarett røking, ultrafiolett lys, mangelernæring inklusiv D- eller C-vitamin mangel, infeksjoner og ulike medikamenter.
Sykdomsutviklingen preges av autoimmune fenomener der et ukjent utløsende agens medfører autoimmun aktivitet. Neutrofile lymfocytter blir aktivert via endotelceller i tarm og andre slimhinner, slik at de samles i stort antall i affiserte organer der de forårsaker inflammasjon og destruer eget vev. Autoantistoff og T-celler er sentrale aktører der økt apoptose av celler (celledød) frigjør agens som stimulerer autoimmunitet. Tarmen inneholder en stor endotelkledd overflate og mengder mikroorganismer. En antar at tarmens mikrobiota er av stor betydning i utvikling av autoimmune sykdommer. Patogenesen er forskjellig for de enkelte sykdommene og er beskrevet i de tilsvarende kapitlene om de enkelte bindevevssykdommene (vennligst se lenker i listen nedenfor).
Kliniske manifestasjoner
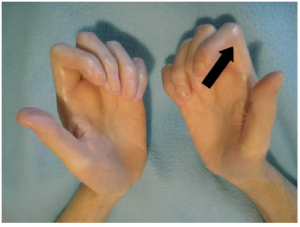
Systemiske bindevevssykdommer preges oftest av systemisk inflammasjon. Dermed føler pasientene seg oftest slappe og utmattet (fatigue). Utmattelsen forløper etter hvert delvis uavhengig av den systemiske inflammasjonen og responderer dårlig på behandling. Systemisk inflammasjon medfører nattesvette, feber, redusert appetitt og vekttap. Typiske sykdoms-manifestasjoner følger i form av artritt, eksantem, vaskulitt i hud og andre organer og ulike organ-manifestasjoner. De ulike sykdommene skilles på bakgrunn av typiske symptomer, organ-manifestasjonene og antistoff. Nærmere beskrivelse, naturlig forløp, potensielle komplikasjoner og prognose er beskrevet i de respektive kapitlene for hver diagnose.
- Systemisk lupus erythematosus (SLE)
- Antifosfolipid syndrom
- Sjøgrens syndrom
- Myositt/dermatomyositt
- Mixed Connective Tissue Disease/MCTD
- Systemisk sklerose
Litteratur
Anaya J-M, Autoimmunity: From bench to bedside, 2013
Gabriel SE, 2009 (epidemiologi)
Jackson M, 2018 (genetikk)
Murakami K, 2019 (antistoff i patogenesen)
