BINDEVEVSSYKDOMMER (REV 021-033)
53 Antifosfolipid syndrom (APS) / APLS og katastrofalt APS, CAPS (REV 021, REV 029)
Antifosfolipid syndrom
Øyvind Palm and Jan Tore Gran
Kjennetegn på antifosfolipid syndrom
Diagnosekoder ICD-10: D68.8 Prosedyrekoder: EKG FPFE15
Definisjon
Antifosfolipid syndrom (APS) kan deles i to former; en primær autoimmun sykdom (primært APS) eller sekundært APS som er relatert til annen autoimmun sykdom, vanligst systemisk lupus erythematosus (SLE). APS. kjennetegnes av venøse og arterielle tromboser og komplikasjoner i svangerskap (spontanaborter, dødfødsler, premature fødsler) ved tilstedeværelse av antifosfolipid antistoffer (APL: lupus antikoagulant, anti-kardiolipin eller anti-beta2 glykoprotein-1 antistoffer). Titer-utslaget er av betydning for alvorlighetsgraden. Anti-kardiolipin antistoff og anti-β2GP ≥40 enheter eller ≥99. persentil oppfattes som signifikant. Høye utslag medfører mer risiko enn lave verdier og pasienter som er “trippel positive” er mest utsatt. CAPS. En spesiell undergruppe av APS er katastrofalt APS (CAPS) som progredierer over timer-dager og omfatter flere organer (vennligst les om CAPS nedenfor i dette kapittelet), mikroangiopatisk og seronegativ APS (Gomez-Puerta JA, 2014).
Historie
Antifosfolipid syndrom ble fullstendig beskrevet så sent som i 1980 årene av E. Nigel Harris og Aziz Gharavi (Ruiz-Irastoza G, 2011). Syndromet ble også kalt “Hughes syndrome” etter Graham R.V. Hughes ved St. Thomas Hospital i London som også beskrev sykdommen i 1983 (Huges G, 1983).
Patogenese
Skyldes tilstedeværelse av antistoffer i serum rettet mot negativt ladede fosfolipider. Fosfolipider finnes på nesten alle cellemembraner. Anti-kardiolipin antistoff synes å være rettet mot det antikoagulerende plasmaproteinet Beta-2-glykoprotein.
Epidemiologi
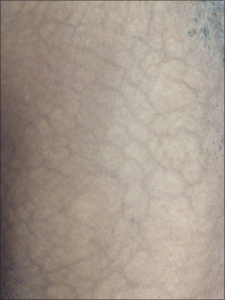
En studie fra Rochester, USA viser årlig insidens 2,1/100.000 og prevalens 50/100.000. SLE foreligger hos 18% (sekundært APS) (Duarte-Garcia A, 2019). Fordelingen mellom kvinner og menn er 5:1 ved APS totalt, 3,5:1 ved primært APS og 7:1 ved SLE-assosiasjon (sekundært APS). APS-antistoff påvises blant ca. 13% av pasienter med slag, 11% med myokardinfarkt, 9,5% med dyp venetrombose og 6% med svangerskapskomplikasjoner (Gomez-Puerta J, Cervera R, 2014). Illustrasjon: Sajjan VV, Lunge S, Swamy MB, Pandit AM – Indian dermatology online journal (2015 Sep-Oct). CC BY -NC-SA 3.0. Sekundært APS Sekundært antifosfolipid antistoff syndrom ses ved autoimmune sykdommer, hovedsakelig SLE der APS ble beskrevet først (Huges GR, 1983). SLE, ca. 40% har APS antistoff, hvorav 50% to 70% utvikler APS over tid (Lim W, 2013). Infeksjoner assosiert med antifosfolipid antistoffer: Lues, HIV, Epstein-Barr virus, Borreliose, tuberkulose, febris rheumatica, malaria, hepatitt-C. Malignitet og antifosfolipid antistoff: Tromboembolier opptrer generelt hyppigere ved cancer og forekomst av antifosfolipid antistoff øker risikoen både ved hematologisk malignitet og solide tumorer (Gomez-Puera JA, 2016). Medikamenter og antifosfolipid antistoffer: Prokainamid, orale prevensjonsmidler. Diverse tilstander hvor antifosfolipid antistoff er beskrevet å forekomme (med ulike insidens): Budd-Chiaris syndrom gir abdominalsmerte, ascites og leversvikt på grunn av tromboser i portalvenen og levervenene. CAPS (Katastrofalt antifosfolipid syndrom) multiple arterielle tromboser i flere organsystem samtidig. Meget alvorlig med opp mot 50 % letalitet (vennligst les mer nedenfor i dette kapittelet), diabetes, dialyse, Crohns sykdom, Evans syndrom utgjøres av trombocytopeni og hemolytisk anemi. Noen av disse pasientene har antifosfolipid antistoff. HELLP syndrom (svangerskap): hemolyse, forhøyde leverenzymer, trombocytopeni og antifosfolipid antistoff, revmatoid artritt, Sjøgrens syndrom, Sneddons syndrom som består av multiple cerebrovaskulære katastrofer, hypertensjon og utbredt livedo reticularis. Genmutasjonen som foreligger er identisk med CECR1 som også forårsaker et lignende sykdomsbilde (med slag og hudforandringer) blant barn (DADA2, juvenil PAN), svangerskap (vennligst les mer nedenfor), thyreoiditt, ulcerøs kolitt, vaskulitt (systemisk).
Sykdomsmanifestasjoner
Tromboser og embolier. Lokalisasjoner er nyrer, binyrer, lever, portvene (Budd-Chiaris syndrom), vena cava inferior, arm-vener (subclavia, axillaris) og cerebral sinus (Biggioggero M, Meroini PL, 2010). Arterielle tromboser kan gi apopleksi, TIA og myokardinfarkt som de tre vanligste arterielle manifestasjoner. Arterie-okklusjoner i ekstremiteter, nyrer, aortabuen, abdominalt og til hud bidrar til ulike symptomer som klaudikasjon, hypertoni, postprandiale abdominale smerter (abdominal angina) og ulike kutane manifestasjoner (beskrevet nedenfor) (Cervera R, 2002).
Kutane manifestasjoner sees hos opp mot 50 % av pasientene og opptrer ved sykdomsstart hos 30 %. Livedo reticularis representerer den hyppigste kutane lesjonen, særlig blant kvinner og sees som et fiolett og retikulært utslett. Noen mener livedo reticularis oftest forekommer hos pasienter med cerebrale og okulære arterielle manifestasjoner. Livedo reticularis skilles fra cutis marmorata som likner, men opptrer som et generalisert utslett og ikke relatert til sykdom. Overfladisk tromboflebitt er sjelden (<2%). (Pinto-Almeida T, 2013). Nyrene kan angripes med trombotisk mikroangiopati, nyrevenetrombose, nyreinfarkt, nyrearteriestenose, malign hypertensjon (Turrent-Cariles A, 2018). Lunger. Lungeblødning (kapillaritt) er en sjelden komplikasjon. Lungeemboli og/eller pulmonal hypertensjon må alltid tas i betrakting ved dyspne. Pumonale mikrotromber er ikke uvanlig og kan være vanskelige å diagnostisere. Lungemanifestasjonene omtales i blant som APL lungesyndrom (Stojanovich L, 2006). Revmatiske symptomer. Leddsmerter (artralgi) ses hos ca. 10%, men er vanligere når antifosfolipid syndrom er sekundært til SLE (artralgi hos ca. 30%). Artritt ses hos ca. 3% med primært antifosfolipid syndrom, men hos 30% ved assosiert SLE. Laboratoriediagnostikk. Trombocytopeni vanlig (20-50%), men er oftest moderat (75-100 000) og uten signifikant klinisk betydning (Artim-Esen B, 2015). Leukopeni ses hos ca. 2%, vanligere ved samtidig SLE (14%). Også hemolytisk anemi er sjelden (<2%) ved primært antifosfolipid syndrom. Immunologiske prøver
- Lupus antikoagulant (Hematologisk laboratorium) er forhøyet
- Anti-kardiolipin IgG og IgM, hvorav signifikant forhøyet IgG tillegges mer vekt enn IgM.
- Anti-B2 glykoprotein 1, IgG og IgM.
- Antistoffene må påvises 2 ganger med 12 ukers intervall
- D-dimer øker ved trombose, emboli og DIC (> 0,4 ug/ml)
Klassifikasjonskriterier
- Vaskulær trombose
- En eller flere episoder med arterielle eller venøse eller små tromboser i hvilket som helst vev eller organ. Tromboser må påvises objektivt validerte ved kriterier. Ved histopatologisk påvist trombose skal det ikke foreligge tegn til inflammasjon i blodåreveggen.
- Svangerskapskomplikasjoner
- Uforklart foster-død en eller flere ganger av morfologisk normalt foster (ultralyd eller direkte undersøkelse) i svangerskaps-uke 10 eller senere eller
- En eller flere uforklarte premature fødsler av morfologisk normale nyfødte før svangerskapsuke 34 på grunn av 1) eklampsi eller alvorlig pre-eklampsi definert etter gjeldende standard, eller 2) påvist placenta-insuffisiens eller
- Tre eller flere uforklarte spontanaborter fortløpende før 10. svangerskapsuke uten at materne anatomiske eller hormonale unormale forhold foreligger. Kromosomale maternale eller paternale defekter skal ikke foreligge.
- Lupus antikoagulant i plasma ved to eller flere anledninger med minst 12 ukers avstand (men innen 5 år).
- Anti-kardiolipin antistoff IgG eller IgM i serum eller plasma i signifikant titer (ELISA >40 GPL eller MPL eller >99 persentil) ved minst 12 ukers avstand (men innen 5 år).
- Anti-beta2-glykoprotein IgG eller IgM i serum eller plasma (ELISA: i titer >99% persentil) ved to eller flere anledninger med minst 12 ukers avstand (men innen 5 år).
Differensialdiagnoser
Falsk positive anti-fosfolipid (APL) antistoff-tester forekommer hos opptil 9,4% av blodgivere. Diagnosen antifosfolipid syndrom (APLS) stilles derfor ikke bare basert på blodprøveresultater, og testen skal vise forendringer over tid. Test igjen etter tre måneder. Falsk negative tester (ingen utslag i testen selv om APLS foreligger) kan også foreligge, men antas å være sjelden: antistoff mot phosphatidylserin, phosphatidylinositol og prothrombin kan være årsaker. Venøs trombose
- Koagulopatier: Faktoranalyser
- Defekter i trombolysesystemet
- Cancer/myeloproliferative sykdommer
- Nefrotisk syndrom med proteintap
Arteriell tromboemboli
- Atrieflimmer
- Myksom
- Endokarditt
- Kolesterol emboli
- Myokardinfarkt med ventrikulær trombose
- Dekompresjonssykdom (Caissons sykdom).
- Trombotisk trombocytopenisk purpura/hemolytisk uremisk syndrom
- Hjerneslag hos barn: DaDa-2 /juvenil PAN
- Sneddons syndrom (overlapp mot DaDa2)
- TIA / slag (Diffusjonsvektet MR kan vise cerebral iskemisk skade)
Kombinert venøs og arteriell okklusjon
- Defekt trombolyse (dysfibrinogenemi eller plasminogen aktivator mangel)
- Degos syndrom
- Homocysteinemi
- Myeloproliferative sykdommer
- Polycytemia vera (hyperviskositet)
- Paroksymal nocturnal hemoglobinuri
- Waldenstrøms makroglobulinemi
- Sigdcelle-sykdom
- Vaskulitt-sykdommer
- Paradoksal emboli (fra venøs til arteriell side via åpent foramen ovale)
Kreftsykdom Økt risiko for tromboser ved kjent kreftsykdom, men også ved ikke erkjent kreftsykdom (initialt symptom før diagnose). En begrenset malignitet-utredning er anbefalt ved trombose uten kjent årsak Andre årsaker til tromboembolier
- Protein S mangel
- Protein C -mangel
- Faktor V Leiden
- Protrombin genmutasjon
- Hyper-homocysteinemi
- MBL-mangel
Litteratur: Emmi G 2014
Behandling av APS
Generelt om trombosehemmende medikamenter Acetylsalicylsyre (ASA) hemmer syntesen av tromboksan gjennom hemming av cyklooksygenase I (COX-1). Gir moderat hemming av trombocyttaggregasjonen (platehemmer). DOAK. Direkte virkende antikoagulantia (DOAK): Apiksaban og rivaroksaban hemmer koagulasjonsfaktor Xa direkte og hemmer omdannelsen av faktor II (protrombin) til faktor IIa (trombin). Dabigatran etexilate hemmer trombin direkte og hindrer omdannelsen av fibrinogen til fibrin (Helsebiblioteket ).
Heparin øker antitrombins inaktivering av faktor Xa og trombin. Hemmer altså koagulasjon. Antidot er protamin. Monitoreres med APTT eller ACT. Dosering: ved DVT gis initialt 150 IE/kg, deretter 400 IE/kg i døgnet. Som tromboseprofylakse 70 IE/kg x 1-2 per døgn. Lavmolekylært heparin / (Fragmin, Klexane) har samme virkningsmåte som Heparin, men har lengre virkningstid og gir sjeldnere trombocytopeni og osteoporose. Monitoreres ikke. Dosering 200 IE/kg/døgn – ved tromboseprofylakse 100 IE/kg/døgn. Marevan (warfarin). Warfarin er en K-vitaminantagonist som hemmer dannelsen av koagulasjonsfaktorene II, VII, IX, X, samt protein C og S. Startdose 7,5-10 mg daglig i 2-3 dager. Monitoreres med TT eller INR. -Økt respons på Marevan kan forårsakes av endogene faktorer som bloddyskrasier, kreft, koronarsykdom, diare, feber, leverdysfunksjon og hypertyreose. Eksogene faktorer, som dårlig ernæring, kan også gi økt warfarin respons. -Redusert warfarin respons sees ved ødem, hyperlipidemi, hypotyreose, nefrotisk syndrom og eksogene faktorer som medikamenter og økt Vit K tilførsel. Streptokinase danner et kompleks med plasminogen og plasmin og gir økning av plasmin som bryter ned fibrin. Forebygging Det er essensielt å redusere risiko for tromboembolier. Supplerende risikofaktorer som hypertensjon, hyperlipidemi, høy homocystein korrigeres. Røking og bruk av østrogenholdige orale prevensjonsmidler unngås (genstagen p-piller kan brukes). Behandlingen bygger på anbefalinger publisert av EULAR i 2019 (Tektonidou MG, 2019). Retningslinjer, anbefalinger og prosedyrer
A. Ved høy-risiko APL profil: Profylakse med ASA 75-100mg/d
B. Ved lav-risiko vurderes profylakse med ASA 75-100mg/d
3. Blant ikke-gravide med tidligere svangerskaps-komplikasjoner (med eller uten SLE) anbefales ASA 75-100mg/d profylaktisk etter adekvat vurdering av risk/nytte. Sekundær trombe-profylakse ved APS 4. Blant pasienter med sikkert APS og første venøse trombose:A. Behandling med Marevan og INR 2–3 anbefales
B. Rivaroxaban (et DOAK) bør ikke brukes ved trippel positiv APL antistoff på grunn av risiko for nye tromboser. DOAK kan vurderes hvis INR-målet ikke er mulig å oppnå til tross for god medikamentoppfølging eller ved kontra-indikasjoner for Marevan (allergi, intoleranse).
C. Blant pasienter med spontan første venøse trombose bør lang tids behandling anti-koagulasjon gjennomføres.
D. Blant pasienter med provosert første venetrombose (risiko-adferd) bør behandlingen kontinueres med samme varighet som for dem uten APS og i henhold til internasjonale retningslinjer. Lengre antikoagulasjon kan vurderes blant pasienter med høy-risiko APL profil eller andre risiko-faktorer for ny trombose.
5. Hos pasienter med sikkert APS og tilbakevendende venøse tromboser til tross for behandling med Marevan og INR 2-3:A. Undersøk compliance/etterlevelse for behandlingen, vurder pasientopplæring og hyppige INR målinger.
B. Hvis behandlingsmålet på INR 2-3 var oppnådd, vurder å legge til ASA 75-100mg/d eller skifte til lavmolekylært heparin.
6. Pasienter med sikker APS og første arterielle trombose:A. Behandling med Marevan er anbefalt fremfor bare lavmolekylært heparin.
B. Behandling med Marevan med INR 2-3 eller INR 3-4 er anbefalt, avhengig av individuell risik for blødning og tilbakevendende trombose. Behandling med Marevan med INR 2-3 i kombinasjon med ASA 75-100mg/d kan også vurderes.
C. Rivaroxaban (et DOAK) bør ikke brukes av pasienter som er trippel positive for APL og har hatt arterielle episoder. Basert på nåværende kunnskap anbefalers ikke DOAK hos pasienter med sikkert APS og arterielle episoder på grunn av høy risiko for residiverende trombose.
7. Blant pasienter med tilbakevendende arterielle tromboser til tross for adekvat behandling med Marevan, etter evaluering av andre årsaker og økning av INR til 3-4, kan supplering med ASA 75-100mg/d eller overgang til lavmolekylært heparin vurderes. Svangerskap. 8. Blant kvinner med en høy-risiko APS profil, men uten anamnestisk trombose eller svangerskaps-komplikasjoner (med- eller uten SLE) vurderes behandling med ASA 75-100mg/d under svangerskap. 9. Blant kvinner med APS relaterte svangerskaps-komplikasjoner, men uten tidligere tromboser (med- eller uten SLE): A. Dersom tidligere ≥3 tilbakevendende spontanaborter gis kombinasjonsbehandling med lavdose ASA og heparin i profylaktisk dose gjennom svangerskap. B. Ved tidligere tidlig-fødsel før svangerskapsuke 34 på grunn av eklampsi, alvorlig preeklampsi eller påvist placenta-insuffisiens anbefales profylaktisk behandling med ASA 75-100mg/d alene eller i kombinasjon med lavmolekylært heparin, basert på individuell risikoprofil. C. Hvis obstetrisk APS ikke helt oppfylles, slik som ved to spontanaborter før svangerskapsuke 10 eller fødsel ≥ uke 34 på grunn av alvorlig pre-eklampsi eller eklampsi kan behandling med ASA alene eller i kombinasjon med lavmolekylært heparin vurderes basert på individuell risikoprofil. D. Obstetrisk APS behandlet profylaktisk med lavmolekylært heparin i svangerskap bør vurderes kontinuert i 6 uker post-partum for å redusere risiko for matern trombose. 10. Blant kvinner som fyller kriteriene for obstetrisk APS med tilbakevendende svangerskaps-komplikasjoner tross kombinasjonsbehandling med ASA og lavmolekylært heparin i profylaktiske doser vurderes høyere heparin-dose opp mot terapeutiske doser eller supplement med hydroksyklorokin (Plaquenil) eller lav-dose prednisolon i første trimester. Intravenøs immunglobulin kan vurderes i svært utvalgte tilfeller. 11. Hos kvinner med tidligere trombotisk APS anbefales en kombinasjon av ASA og lavmolekylært heparin i terapeutiske doser i svangerskap.Obstetrisk antifosfolipid syndrom med spontanaborter eller fosterdød skyldes en eller flere sykdomsassosierte faktorer: Tromboser i placenta, komplement-aktivering, påvirkning av trofoblast-vekst (cellelaget som omgir embryoblasten) og differensiering, samt redusert trofoblast-invasjon og hormonproduksjon. Ved høy spontanabort-risiko vurderes ASA i lav dose, for eksempel 75mg/døgn, initiert allerede før konsepsjon (Skorpen CG, 2021). Seponering 3 uker før forventet fødsel kan være aktuelt dersom Fragmin/Klexane/lavmolekylært heparin benyttes samtidig. Fragmin/Klexane/lavmolekylært heparin stanses minst 10 timer før fødselsinduksjon eller keisersnitt, men kan startes igjen 6-8 timer etter fødsel eller keisersnitt (NKSR). Se info også om antikoagulantia, og om antifosfolipid syndrom fra NKSR
Katastrofalt antifosfolipid syndrom (CAPS)
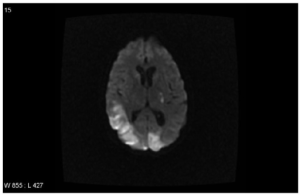
Definisjon av CAPS. Livstruende komplikasjon av APS der flere organer angripes samtidig. Histologisk ses okklusjoner i multiple små blodårer (trombotisk storm). Forekommer i ca. 1% ved APS (Cervera R, 2005). Illustrasjon: Strakhan M, Hurtado-Sbordoni M, Galeas N, Bakirhan K, Alexis K, Elrafei T – Case reports in hematology (2014). CC BY 3.0 Diagnose av CAPS. Det er essensielt å ekskludere andre sykdommer og syndromer som angriper flere organer samtidig.
| Differensialdiagnoser for CAPS (Kazzaz, NM, 2016) | ||||||
| CAPS (catastrophic antiphospholipid syndrome) | TTP-HUS (TTP, thrombotic thrombocytopenic purpura; HUS, hemolytic uremic syndrome) | DIC (disseminated intravascular coagulation) | HELLP (hemolysis, elevated liver enzymes, low platelets) | SRC (scleroderma renal crisis) | HIT (Heparin indusert trombocytopeni) | |
| Mikrovaskulær trombose | + | + | + | + | + | – |
| Makrovaskulær trombose | + | – | – | + | – | + |
| Blødning | – | – | + | +/- | – | – |
| Multiorgansvikt | ++ | +/- | +/- | +/- | – | – |
| Nyresvikt | +/- | ++ | – | +/- | ++ | – |
| Redusert mentalt | +/- | +/- | – | +/- | – | – |
| Lungesykdom (ARDS) | ++/- | – | +/- | +/- | – | – |
| Hjertesykdom (Infarkt, svikt) | +/- | – | – | – | – | – |
| Svangerskap | +/- | – | +/- | + | – | – |
| Infeksjon | +/- | +/- | +/- | – | – | – |
| Malignitet | +/- | – | +/- | – | – | – |
| Hemolytisk anemi | +/- | ++ | +/- | + | + | – |
| Schistocytter | +/- | ++ | +/- | + | + | – |
| Trombocytopeni | +/- | ++ | + | + | +/- | ++ |
| Forlenget PTT | +/- | – | + | – | – | – |
| Fibrinogen | Normal | Normal | ↓ | Normal | Normal | Normal |
| Leverenzymer | ↑ | Normal | Normal | ↑↑ | Normal | Normal |
| APL (>40 U/ml) | ++ | – | – | – | – | – |
| ADAMTS13 | Normal | ↓↓↓ | ↓ | Normal | Normal | Normal |
| Anti-PF4 | – | – | – | – | – | ++ |
Klassifikasjonskriterier for CAPS
- Påvist affeksjon av tre eller flere organer, organsystemer eller vev (oftest okkluderte blodårer og nyre-manifestasjon/alvorlig hypertoni)
- Utvikling av manifestasjoner samtidig eller i løpet av en uke
- Histologisk okklusjon i små blodkar i minst ett organ eller vev
- Laboratorieprøver: Lupus antikoagulant, og/eller anti-kardiolipin antistoff (hvis ikke kjent APS skal positive prøver foreligge ved to anledninger med minst 6 ukers intervall)
- Alle fire kriterier, bortsett fra at bare to organer/organsystemer/vev affiseres.
- Alle fire kriterier, bortsett fra at laboratorieprøvene ikke er bekreftet etter minst 6 uker (grunnet ikke testet før eller død)
- 1, 2 og 4
- 1,3 og 4 og utvikling av en tredje manifestasjon etter mer en en uke, men mindre enn en måned, til tross for antikoagulasjon.
Behandling av CAPS A. Umiddelbar behandling av infeksjoner hos alle APL-positive individer og minimaliser avbrudd i antikoagulasjons-behandling eller for lav INR hos pasienter med trombotisk APS for å hindre utvikling av CAPS. B. Som første-linje behandling ved CAPS anbefales en kombinasjon med glukokortikoid, heparin og plasmaferese eller intravenøs immunglobuliner fremfor ett enkelt medikament eller andre medikament-kombinasjoner. I tillegg bør alle utløsende faktorer som infeksjoner, gangren eller malignitet behandles. Blant pasienter med refraktært CAPS kan B-celle hemming (rituksimab) eller komplement-hemmer (eculizumab) vurderes.
Prognose
Mortaliteten er økt når antifosfolipid syndrom er assosiert med SLE (Cervera R, 2002). En retrospektiv russisk studie viste at 8 års overlevelse ved SLE uten antifosfolipid syndrom var 98% sammenlignet med 75% ved SLE med sekundært APS og 83% ved primært antifosfolipid syndrom (Reshetniak TM, 2003). Vanligste dødsårsaker er alvorlige tromboembolier (slag, myokardinfarkt, lungeemboli) eller CAPS (Cervera R, 2002).
Svangerskap ved antifosfolipid syndrom
Alvorlige komplikasjoner i svangerskap ved primært- og sekundært antifosfolipid syndrom ses i 20-30% av tilfellene (Schreiber K, 2019). Vanligst er tidlig eller sent fostertap og premature fødsler. Pre-eklampsi, eklampsi, HELLP syndrom og placenta-ruptur forekommer også. I EURO-fosfolipid-prosjektet som begynte i 1999 ble 1000 uselekterte pasienter med APS evaluert. Tidlig-fødsler forelå hos 72,3%, intrauterin vekthemming hos 51,1% som indikerer høyere risiko enn for SLE (Cervera R, 2002). Disse historiske data viser komplikasjonsraten den gang. Imidlertid har behandling og oppfølging endret seg betydelig i ettertid, slik at bedre resultater ved oppfølging oppnås nå. Antifosfolipid syndrom må uansett følges opp som risikosvangerskap. Pasienter med APLS følges opp som «risikosvangerskap» der gynekolog/fødselslege og hematolog. Ved sekundært APLS (hvis også SLE, Sjøgrens eller annen revmatisk sykdom foreligger) samarbeider en med revmatolog. Lupus antikoagulant, kardiolipin antistoff og beta-2 glykoprotein øker risikoen for trombose og komplikasjoner relatert til graviditet, uavhengig av om revmatisk sykdom foreligger eller ikke. Personer med høye nivåer av antistoffene, særlig lupus antikoagulant eller ved forekomst av alle tre antistoff (trippel positive), er mest utsatt. Man kan dele disse antistoffene i IgG og IgM antistoff, hvorav høye nivå av IgG antistoff anses er av større betydning enn IgM nivå og høye nivå er verre enn lave nivå. Risiko for tromboemboli er uansett økt i svangerskap og i ukene etter fødsel. Den gravide kan få tromboembolier som dyp venetrombose (DVT), lungeemboli eller slag. Fosteret kan rammes via blodpropper i placenta og dermed økt risiko for abort eller dødfødsel. Forebyggende tiltak. Ved APLS (se ovenfor) gis antikoagulantia. Marevan må imidlertid ikke brukes under svangerskap på grunn av økt risiko på ca 6% for fosterskade ved bruk etter svangerskaps uke 9 (warfarin-embryopati; Wainwright H, 2010). Direktevirkende antikoagulantia (DOAK) anbefales heller ikke, fordi økt rate spontanaborter og misdannelser ikke kan utelukkes (Beyer-Westendorf J, 2020). Heparin og lavmolekylære hepariner kan imidlertid brukes. I svangerskap brukes ofte acetylsalisylsyre (ASA, Albyl-E 75 mg/dag) og Fragmin, Klexane eller Heparin injeksjoner. Antikoagulantia kan begrense mulighet for epidural anestesi ved fødsel. Etter fødsel kan en etter 2-3 uker vurdere å starte Marevan igjen (hvis brukt før svangerskap). INR nivå kan variere og skape doseringsproblemer kort tid etter fødsel. Alternativt brukes Fragmin eller Klexane ca. 6 uker etter fødsel. Data tyder på at også Plaquenil (hydroksyklorokin) kan ha noe blodpropp beskyttende virkning (og kan redusere nivået av SSA/B antistoff), også under svangerskap (Sciascia S, 2015). Ved alle spontanaborter må andre årsaker også vurderes og avdeling med spesiell kompetanse konsulteres ved gjentatte spontanaborter. Ved “behandlingsresistent” antifosfolipidsyndrom, har en i noen tilfeller sett nytte av supplerende behandling med Prednisolon 10mg/dag frem til svangerskapsuke 14 og på spesielle indikasjoner som alvorlig placentasvikt og preeklampsi har pravastatin 20mg/dag, intravenøs immunglobuliner (2g/kg kroppsvekt pr. måned) og / eller plasmautskiftning (plasmaferese) også vært brukt ved spesialavdelinger (Uthman I, 2019).
Katastrofalt antifosfolipid syndrom (CAPS) og svangerskap). CAPS kan debutere under svangerskap og er forbundet med økt risiko for død. Tilstanden kjennetegnes ved rask, dramatisk utvikling (innen mindre enn 1 uke) og at flere organer angripes samtidig (multiorganaffeksjon). For å redde mors liv, kan det i noen tilfelle være nødvendig å gi behandling selv med risiko for å skade fosteret. Uvanlig høye doser av Fragmin eller Klexane, IVIG (intravenøse immunglobuliner), kortikosteroider og/eller Plaquenil kan brukes. Noen gir også plasmautskiftning (plasmaferese).
Litteratur
Bustamante JG, 2021 Tektonidou, MG, 2019 EULAR Behandling Pons-Estel GJ, 2016 Miyakis S, 2006 Cervera R, Arthritis Rheum 2002 Schreiber K, 2019 (svangerskap)
